
制造导弹的雷达罩和宇航员使用的氧气瓶的主要材料是透明聚酯玻璃钢,制备它的一种配方中含有下列四种物质:




(甲) (乙) (丙) (丁)
填写下列空白:
(1)甲中不含氧原子的官能团是______(1分);甲分子_____(1分)(填“有”或“无”)顺反异构现象;下列试剂能与甲反应而褪色的是(填标号) 。
a. Br2/CCl4溶液 b. 石蕊溶液 c.酸性KMnO4溶液
(2)写出乙与足量Na反应的化学方程式 。
(3)已知: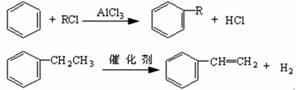
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 。
(4)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用显现特征颜色,且丁分子中上的一氯取代物只有一种。则丁的结构简式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
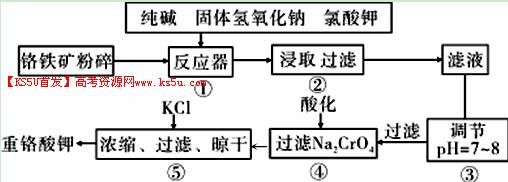
(1)碱浸前将铬铁矿粉碎的目的是 。
(2)步骤③调节pH后过滤得到的滤渣是 。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 。
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于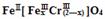 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。
(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4 • 7H2O,下列结论正确的是_______。
A.x =0.5 ,a =8 B.x =0.5 ,a = 10 C.x = 1.5 ,a =8 D.x = 1.5 ,a = 10
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁等铁制品是应用最广泛的金属材料,铁元素的单质及其化合物在元素化合物世界始终扮演着重要角色。
Ⅰ.打磨过的细铁丝可在纯氧中剧烈燃烧,最终生成黑色固体,其化学式为______________;铁粉与水蒸气在高温下也可生成该黑色固体,反应的化学方程式为________________________________________________________________________。
Ⅱ.某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如图94所示。
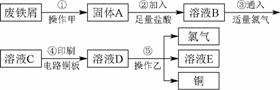
图94
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是________________。
(2)步骤②中,除发生反应Fe+2HCl===FeCl2+H2↑外,其他可能反应的离子方程式为________________________________。
(3)溶液C的颜色是__________,溶液D中可能含有的金属阳离子有____________________。
(4)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是__________。
①先加氯水,后加KSCN溶液后显红色;
②先加KSCN溶液,不显红色,再加氯水后显红色;
③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色;
④只滴加KSCN溶液不显红色。
A.①② B.②③
C.③④ D.①④
(5)步骤⑤产生金属铜的化学方程式为________________________________________________________________________
________________________________________________________________________。
Ⅲ.金属的腐蚀所导致的钢铁损耗占钢铁年产量的1/4还多。在钢铁的吸氧腐蚀过程中,正极反应式为________________________________________________________________________,
若此过程中共生成了8 g Fe2O3,则转移的电子的物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种饱和一元醇,它们分子中的碳原子数相差1,又知它们的混合物8g与足量金属Na反应生成2.24L气体(标准状况),而两种醇中含碳原子数少的是
A.丁醇 B.丙醇 C.乙醇 D.甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中肯定不正确的是( )
①某原子K层上只有1个电子
②某原子M层上的电子数为L层上电子数的4倍
③某离子M层上和L层上的电子数均为K层的4倍
④某离子的核电荷数与最外层电子数相等
A.①③ B.②
C.③④ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X是形成化合物最多的元素且X常见化合价为+1和-1,Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍。下列叙述不正确的是( )
A.原子半径的大小顺序:rZ>rW>rY>rX
B.元素Y的简单气态氢化物的热稳定性比W的弱
C.化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂
D.由X、Y、Z、W四种元素组成的化合物其水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应精制CuO,其设计的实验过程为:
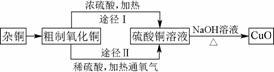
图93
(1)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是________________________________________________________________________。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(2)由粗制氧化铜通过两种途径制取纯净CuO,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是________________________________________________________________________
________________________________________________________________________。
(3)有同学指出,由CuSO4溶液到生成CuO少了一个环节,即应先生成Cu(OH)2沉淀,过滤洗涤后再加热分解Cu(OH)2得CuO。以下说法不可能成为减少该环节的理由的是________。
A.CuO比Cu(OH)2颗粒粗大,更易于过滤从溶液中分离
B.Cu(OH)2分解温度较低,加热其浊液即可使其分解
C.干态下分解Cu(OH)2,温度难以控制,可能因温度过高导致CuO进一步分解生成Cu2O
D.过滤分离出的CuO不需洗涤就已非常纯净
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com