
【题目】下列物质中,含有离子键的化合物是
A.KOHB.H2OC.HClD.H2
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
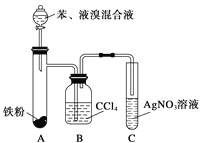
请回答下列问题:
(1)装置A中发生反应的化学方程式是______________________________。
(2)装置C中看到的现象是__________________,证明_________。
(3)装置B内盛有四氯化碳,实验中观察到的现象是_____________,原因是____。
(4)如果没有B装置,将A、C直接相连,你认为是否妥当(填“是”或“否”)________,理由是_________________________________。
(5)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯____层(填“上”或“下”)为溴苯,这说明溴苯____________且____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 Zn(s) +H2SO4(aq)==ZnSO4(aq) +H2(g)的反应过程如下图所示, 下列叙述中不正确的是( )
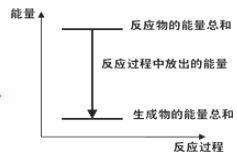
A. 若将该反应设计成原电池,正极可以是C 棒或 Fe 棒
B. 反应过程中滴加少量CuSO4 溶液可加快该反应的反应速率
C. H2SO4 的总能量大于ZnSO4 的总能量
D. 若将该反应设计成原电池,当有 32. 5g 锌溶解时,正极产生的气体在标的体积为 11. 2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常利用含硫废水生产Na2S2O3,原理是 S+Na2SO3![]() Na2S2O3 (Na2S2O3 稍过量,且该 反应的速率较慢;在酸性条件下,Na2S2O3 会自身发生氧化还原反应生成 SO2)。实验室可用如图装置(略 去部分夹持仪器)模拟生产过程。
Na2S2O3 (Na2S2O3 稍过量,且该 反应的速率较慢;在酸性条件下,Na2S2O3 会自身发生氧化还原反应生成 SO2)。实验室可用如图装置(略 去部分夹持仪器)模拟生产过程。
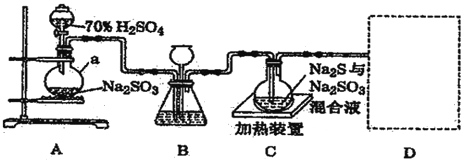
(1)Na2S2O3 中硫元素的化合价_______________。
(2)仪器 a 的名称______________,装置A中产生气体的化学方程式为_________________________ 。
(3)装置 B 的作用除观察 SO2 的生成速率外,长颈漏斗的作用是 ______________________________ 。
(4)装置 C 中需控制在碱性环境,否则产品发黄(生成黄色物质),用离子方程式表示其原因_________。
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___________(填字母)。
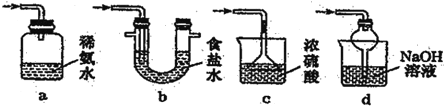
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应H2(g)+I2(g)![]() 2HI(g)达到平衡的标志是( )
2HI(g)达到平衡的标志是( )
A. v(H2):v(HI)=1:2
B. H2、I2、HI分子个数比为1:1:2
C. 混合气体中I2和H2的体积分数相等
D. 混合气体的颜色不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X 是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
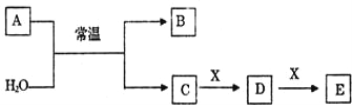
(1)若 A 为常见的金属单质,焰色反应呈黄色,X 能使品红溶液褪色,写出 C 和 E 反应的离子方程式:______________________________。
(2)若 A 为淡黄色粉末,X 为一种最常见的造成温室效应的气体。则鉴别等浓度的 D、E 两种溶液,可 选择的试剂为_____(填代号)。
A.盐酸 B.BaCl2 溶液 C.Ca(OH)2 溶液
(3)若 A 为非金属氧化物,X 是 Fe,溶液 D 中加入 KSCN 溶液变红。则 A 与 H2O 反应的化学反应方程 式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO的化学反应方程式(HAc表示醋酸): Cu(NH3)2Ac+CO+NH3==Cu(NH3)3 (CO) Ac。
请回答下列问题:
(1)C、N、O的第一电离能由大到小的顺序为________。
(2)配合物Cu(NH3)3 (CO) Ac中心原子的配位数为________,基态铜原子核外电子排布式为_________________。
(3)写出与CO互为等电子体的粒子________ (任写一个) 。
(4)在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中,C原子轨道的杂化类型为________;1 mol尿素分子中,σ键的个数为____________。(设NA为阿伏加德罗常数的值)
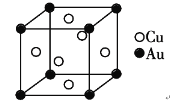
(5)铜金合金形成的晶胞如图所示,其中Cu、Au原子个数比为________。铜单质晶胞与铜金合金的晶胞相似,晶胞边长为3.61×10-8cm,则铜的密度为________g/cm-3(结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制备乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的) 制取乙酸乙酯
(1).(实验原理) 甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸作吸水剂和__________。
(2).(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
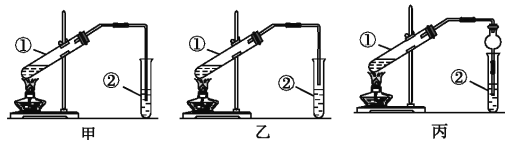
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是______(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是__________。
(实验步骤)
①按你选择的装置组装仪器,在试管中先加入3mL乙醇,然后边振荡试管①边慢慢加入2mL浓H2SO4和2mL乙酸;
②将试管①固定在铁架上;
③在试管②中加入适量的饱和Na2CO3溶液;
④用酒精灯对试管①缓慢加热;
⑤当观察到试管②中有明显现象时停止实验。
(3).(问题讨论)
a.步骤(1)装好实验装置,加入样品前还应检查__________;
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、__________;
c.试管②中分离出乙酸乙酯的实验操作是__________。
d.写出制备乙酸乙酯的化学方程式:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com