
| A.配制银氨溶液:在一定量AgNO3溶液,滴加氨水至沉淀恰好溶解。 |
| B.在检验醛基配制Cu(OH)2悬浊液时:在一定量CuSO4溶液中加入少量NaOH溶液 |
| C.验证RX为碘代烷,把RX与烧碱水溶液混合加热将溶液冷却后再加入硝酸银溶液 |
| D.无水乙醇和浓硫酸共热到170℃,将制得的气体通入酸性高锰酸钾,可检验制得的气体是否为乙烯 |
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:不详 题型:实验题
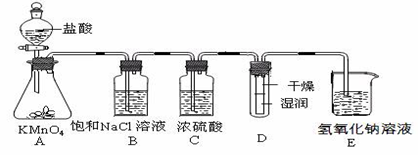
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
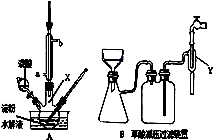
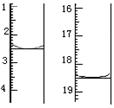
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
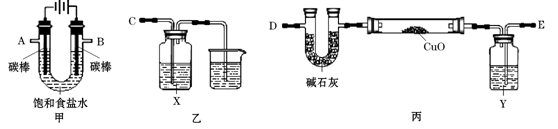
| 方 案 质 量 | 方案一 | 方案二 |
| U型管+固体 | 硬质玻璃管+固体 | |
| 反应前质量/g | a | c |
| 完全反应后质量/g | b | d |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.将配好的稀硫酸倒入试剂瓶中,贴好标签; |
| B.盖好容量瓶塞,反复颠倒,摇匀; |
| C.用量筒量取ml的18.0mol·L-1的浓硫酸; |
| D.将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中; |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |
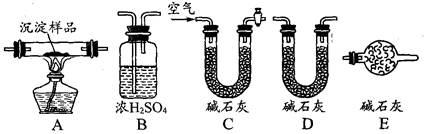
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com