
| A. | NH3、CO、CO2都是极性分子 | |
| B. | CH4、CCl4都是含有极性键的非极性分子 | |
| C. | NH3、PH3、AsH3的稳定性和沸点随 N、P、As 的核电荷数的变化趋势如图所示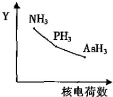 | |
| D. | CS2、H2O、C2H2都是直线型分子 |
分析 A.分子结构对称,正负电荷中心重合的属于非极性分子,否则为极性分子;
B.不同非金属元素之间形成非极性键;
C.氨气分子间存在氢键,沸点比同主族其它氢化物的沸点高;同主族从上到下氢化物的稳定性减弱;
D.H2O的空间构型为V形.
解答 解:A.NH3、CO分子结构不对称,正负电荷中心不重合属于极性分子,CO2分子结构对称,正负电荷中心重合属于非极性分子,故A错误;
B.CH4中只含有C-H极性键,CCl4中只含有C-Cl极性键,CH4、CCl4的空间构型为正四面体,分子结构对称,正负电荷中心重合的属于非极性分子,故B正确;
C.氨气分子间存在氢键,沸点比同主族其它氢化物的沸点高,所以图象不符合;同主族从上到下氢化物的稳定性减弱,NH3、PH3、AsH3的稳定性减弱,故C错误;
D.H2O的空间构型为V形,不是直线型分子,CS2、C2H2都是直线型分子,故D错误.
故选B.
点评 本题考查了分子的极性和分子空间构型、以及同一主族元素氢化物性质递变规律,题目难度不大,注意把握键的极性和分子的极性的判断方法.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 ①氢气 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 ②稀盐酸 | ③产生气泡沉淀全部溶解 | 白色不溶物可能含有猜测2中不溶物 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 ④CO32- |
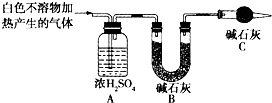
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SiC>C(金刚石)>Si | B. | Al>Mg>Na | C. | H2O>H2Se>H2S | D. | KCl>NaCl>LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
煤的直接燃烧会对大气造成严重污染,是雾霾形成的一个重要原因。实现煤的清洁利用迫在眉睫。乙醇、甲醇、尿素等均与煤化工相关。
Ⅰ.(1)将煤转化成水煤气可有效提高能源利用率:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
CO(g)+H2(g) ΔH=+131.3KJ/mol,反应的平衡常数表达式为K= 。
(2)一定温度下,在体积可变的容器中投入反应物进行此反应,则下列说法正确的是
A.体系中加入催化剂(其他条件保持不变),平衡不移动但反应的ΔH 将变大
B.若正、逆反应比值恒定,则说明平衡已建立
C.建立平衡后,加压,气体的平均相对分子质量将增大
D.建立平衡后,加压,平衡向逆方向移动,平衡常数减小
Ⅱ.乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。
2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
CH3CH2OH(g)+3H2O(g) ΔH= a KJ/mol
在一定压强下,测得上述反应的实验数据如下表。

根据表中数据分析:
(3)上述反应的a 0(填“>”“<”或“=”)
(4)在温度为T1时,该反应的平衡常数K=1,在2L密闭容器中加入一定量体系各物质,反应的某时刻测得反应体系中各气体均为1mol。
①此时V(CO2)正= V(CO2)逆(填“>”“<”或“=”)
②若反应在恒压绝热容器中进行,达平衡后,CO2的物质的量
A.大于1mol B.等于1mol C.小于1mol D.不确定
Ⅲ.CO2亦是合成尿素的重要原料,以CO2与NH3为原料合成尿素[化学式为[CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) ΔH=+l59.5kJ·mol-1
②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用 | |
| B. | 工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目失明甚至死亡 | |
| C. | 蜂蚁叮咬人的皮肤时将分泌物甲酸注入人体,此时可在患处涂抹小苏打或稀氨水 | |
| D. | 不粘锅的表面涂有聚四氟乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com