
【题目】第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是________。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有 6个σ键和1个大π键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和 Fe的部分电离能数据如下表:

Mn元素价电子排布式为________,气态 Mn2+再失去一个电子比气态 Fe2+再失去一个电子难,其原因是___________________________。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于_______区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则 X的化学式为___________。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被 NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为___________
②与CNO-互为等电子体微粒的化学式为__________(写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
【答案】
(1)AD
(2)3d54s2;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少
(3)26
(4) d
(5)TiO2
(6)①H<C<N<O ② CO2或N2O或SCN- ③N≡C-O-H
【解析】
试题分析:(1)A.甲醛中氧元素电负性很大,与水分子中H原子可以形成氢键,故A正确;B.CH2O分子中C原子形成3个σ键,而CO2分子中C原子形成2个σ键,均没有孤电子对,HCHO分子中C原子采用sp2杂化,二氧化碳分子中C原子为sp杂化,故B错误;C.C6H6分子中含有12个σ键和1个大π键,故C错误;D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,故答案为AD;
(2)Mn元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理书写其基态原子核外电子排布式为[Ar]3d54s2,其价电子排布式为3d54s2,Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多,而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少;
(3)Fe原子核外电子数为26,原子核外没有运动状态相同的电子,即铁原子核外有26种运动状态不同的电子;
(4)Ti处于第四周期第ⅣB族,属于d区元素,故答案为:d;
(5)每个晶胞中含有钛原子数为8×![]() +1=2,氧原子数为4×
+1=2,氧原子数为4×![]() +2=4,故化学式为TiO2;
+2=4,故化学式为TiO2;
(6)①同周期从左向右电负性逐渐增大,非金属性越强电负性越大,故电负性大小为H<C<N<O;
②与CNO-互为等电子体微粒含有3个原子、价电子总数为16,故与CNO-互为等电子体微粒的化学式CO2、N2O、SCN-等;
③碳形成4个共价键,氮为三个共价键,氧形成2个共价键,氢形成1个共价键,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H。


科目:高中化学 来源: 题型:
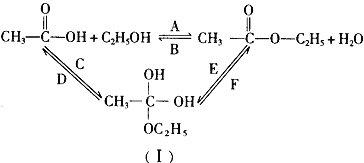
【题目】工业上可以用石油或淀粉作原料生产乙醇。
(1)用石油作原料生产乙醇的一系列反应如下图所示
![]()
选择一种合适的试剂,完成反应③的化学方程式___________________________。
(2)用淀粉为原料生产乙醇,需经水解.发酵等过程。写出水解.发酵涉及的化学方程式(提示:发酵过程中有CO2放出)______________________________________________。
(3)乙醇跟乙酸在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(I),如图所示。在A~F 6个反应中,属于取代反应的是______________(填字母,下同);属于加成反应的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是重要的化工原料,也是重要的工业溶剂。实验室制备环己酮的原理、有关数据及装置示意图如下:
反应原理: 
反应放热,温度过高或者重铬酸钠过量会进一步氧化。
主要物料及产物的物理参数:
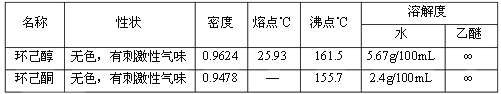
实验装置:

实验步骤:
1.投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下。将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用。
2.反应:将约1/5的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀。冷水浴冷却,控制反应温度在55~60℃。待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中。当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
3.蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90~99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
4.萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层。水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥; 5.蒸馏,收集环己酮产品2.6g。 请回答下列问题:
(1)装置A的名称是___________。
(2)完成并配平反应方程式:
![]()
(3)反应过程中加入甲醇后有无色气体生成。加入甲醇的作用是___________,请用离子方程式表示反应原理___________。
(4)步骤4向馏出液加入食盐的目的是___________,将乙醚提取液和有机层合并的原因是___________。
(5)计算所得产品的产率___________。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g)=2NO2(g)体系中,n(NO)随时间的变化如下表:

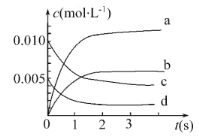
(1)上述反应在第5 s时,NO的转化率为 。
(2)如图中表示NO2变化曲线的是 。用O2表示0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v (O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
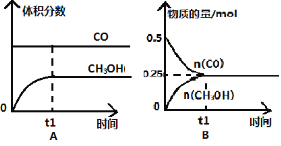
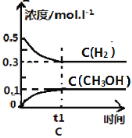

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
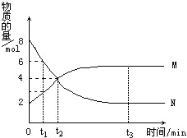
A、反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题

(1)⑤和⑧的元素符号是_______和_______。
(2)表中最活泼的金属元素是___________,形成化合物种类最多的元素是_________(填写元素名称)。
(3)表中能形成两性氢氧化物的元素是___________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:__________________;__________________。
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成,下图中所列装置是用燃烧法确定有机物分子式常用的装置。
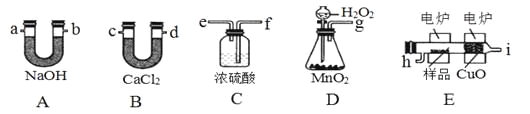
回答下列问题:
(1)产生的氧气按从左到右流向,所选择的装置各导管的连接顺序是____。
(2)C装置中浓硫酸的作用是________。
(3)若准确称取7.2g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加22g,B管质量增加10.8g,则该有机物的实验式为____。
(4)要确定该有机物的分子式,则 (“是”或“不”)需要测定其他数据;若能确定其分子式,其一氯代物只有一种,则其结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com