
【题目】把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
【答案】(1)x= 1;(2) 0.25mol·L-1。
【解析】
试题分析:(1)把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后达平衡,容器内压强变小,说明该反应的正反应是气体体积减小的反应,故3+1>x+2,所以x<2,即x=1;(2) D的平均反应速率为0.1mol/(L.min),则△n(D)=0.1mol/(L·min) ×2L×5min=1mol,根据物质反应时的物质的量的比等于方程式的化学计量数的比可知反应消耗C的物质的量是△n(C)=1/2△n(D)= 0.5mol,则c(C)= 0.5mol/2L=0.25mol·L-1。
xC(g)+2D(g),5min后达平衡,容器内压强变小,说明该反应的正反应是气体体积减小的反应,故3+1>x+2,所以x<2,即x=1;(2) D的平均反应速率为0.1mol/(L.min),则△n(D)=0.1mol/(L·min) ×2L×5min=1mol,根据物质反应时的物质的量的比等于方程式的化学计量数的比可知反应消耗C的物质的量是△n(C)=1/2△n(D)= 0.5mol,则c(C)= 0.5mol/2L=0.25mol·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]常用作化学试剂,也用于冶金、电镀等
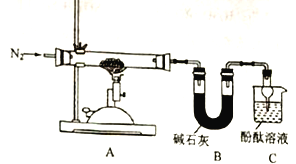
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验硫酸亚铁铵强热时的分解产物。
装置B的主要作用是______________________________。
装置C中可观察到的现象是______________________________。
(2)乙组同学选用甲组实验中的装置A和下图所示的装置,进行实验验证:硫酸亚铁铵晶体分解的产物中还含有SO3(g)、SO2(g)。
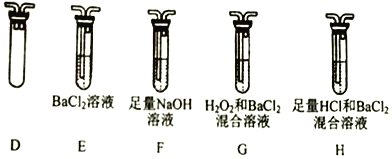
①乙组同学的实验装罝中,依次连接的合理顺序为A→______→______→______→______。
②要证明分解产物中有SO2,开始加热前应____________________,证明产物中有SO2的实验现象为_________________________;能证明分解产物中有SO3的实验现象是____________________。
(3)设计实验证明A中硫酸亚铁铵完全分解后的固体产物中只含Fe2O3:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,将2mol X、2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)![]() mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
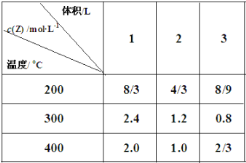
A.m=2 ,ΔH>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池工作时发生复杂的铜腐蚀现象,电池总反应为:2Li+Cu2O+H2O=2Cu+2Li++2OH,其工作原理如图所示,下列说法不正确的是
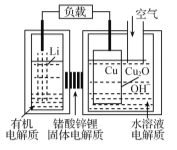
A.电池放电时,正极附近溶液pH增大
B.工作时,Li+透过固体电解质向Cu极移动
C.电池放电过程中,空气中的O2并不参加反应
D.两极的有机电解质和水溶液电解质不可对换
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,某无色溶液中,由水电离出的c(H+)=1×10-14 mol/L,则该溶液中,一定能大量共存的离子是( )
A.K+、Na+、MnO4-、SO42- B.Na+、CO32-、AlO2-、Cl-
C.K+、Na+、Cl-、Br- D.K+、Cl-、Ba2+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不合理的是
A. 用SO2漂白纸浆和草帽辫
B. 用硫酸清洗锅炉中的水垢
C. 高温下用焦炭还原SiO2制取粗硅
D. 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为___________。已知N2O与CO2分子具有相似的结构,试画出N2O的结构式_______。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g)![]() N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式___________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g)![]() N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的____极,电解池中生成N2O5的电极反应式为_____________。
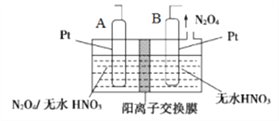
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式_____________。
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少____ml氨气,使溶液呈中性(溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是( )
A.给反应体系适当加热
B.向反应体系中加水稀释
C.加入少量氧化铜固体
D.加压
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com