
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。



(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则_______曲线表示恒温恒容的情况,在该情况下混合气体中w(C)_________(填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是_____(填“放热”或“吸热”)反应,x的值为________(填范围)。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_________________ (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
【答案】b a 变小 吸热 大于2 ①②③
【解析】
(1).使用催化剂加快反应速率,缩短到达平衡的时间,由图可知,a先到达平衡,故a曲线表示使用催化剂,b曲线表示没有使用催化剂,故答案为:b;
(2).恒温恒容下,充入惰性气体He,反应混合物各组分的浓度不变,平衡不移动,反应混合物各组分的百分含量不变,由图可知,a曲线C的百分含量不变,b曲线到达新平衡后C的百分含量降低,所以a曲线表示恒温恒容条件下向平衡混合气体中充入He气,故答案为:a;不变;
(3)由图可知,压强相同时,温度越高,C的百分含量越大,即升高温度,平衡向正反应方向移动,升高温度,平衡向吸热方向移动,所以正反应为吸热反应;温度相同时,压强越大,平衡时C的百分含量越低,即增大压强,平衡向逆反应方向移动,增大压强平衡向气体体积减小的方向移动,则x>2,故答案为:吸热;大于2;
(4).该反应的正反应为气体体积增大的吸热反应,升高温度,平衡向吸热方向移动,即向右移动,由图可知,纵轴所表示的量随温度升高而增大,升高温度,平衡向吸热方向移动,即向右移动,C的百分含量增大,A、B的转化率增大,平衡时A、 B浓度降低;该反应的正反应为气体体积增大的反应,在恒容条件下,升高温度,平衡向吸热方向移动,即向右移动,混合物总的物质的量增加,所以平衡时,容器内压强增大,但起始压强不为0,所以①②③符合,故答案为:①②③。


科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。下列说法不正确的是( )

A. a管发生吸氧腐蚀,b管发生析氢腐蚀
B. 一段时间后,a管液面高于b管液面
C. a处溶液的pH增大,b处溶液的pH减小
D. a、b两处具有相同的电极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某反应达到平衡,其平衡常数为 K=c(CO2)·c(NO)/c(NO2)·c(CO),恒容时升高温度,混合气体的颜色加深,下列说法不正确的是
A. 该反应的焓变为负值
B. 化学方程式为 NO2(g)+CO(g)CO2(g)+NO(g)
C. 降温,正反应速率减小
D. 恒温时,增大压强颜色加深,平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=___________。
(2)关于反应①下列说法,正确的是___________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如下图所示:

①从反应开始到5min时,生成甲醇的平均速率为___________。
②H2的平衡转化率α=___________%,化学平衡常数K=___________。
③1min时,υ正___________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正___________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小_________________________________。
③若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数___________0.1。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺做实验,流程如下:

请回答下列问题:
(1)操作Ⅰ的名称为_______。
(2)验证溶液B中是否含有Fe3+的方法:_______________________,
(3)不溶物A是___(填化学式),写出D→E反应的离子方程式______________。
(4)说出溶液F中含碳元素溶质的一种用途____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示。如CH3—CH=CH—CH3,可简写为![]() 。有机物X的键线式为
。有机物X的键线式为![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. X的化学式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式可以为![]()
C. X能使高锰酸钾酸性溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究所研制的锌碘液流电池,使用寿命长,可自我恢复。锌碘液流电池充电的工作原理如图所示,下列说法正确的是
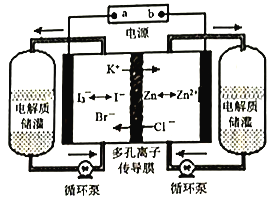
A. 放电时,正极反应式是I3-+2e-=3I-
B. 充电时,b是电源的正极
C. 充电时,外电路通过2mol电子,则有2molK+通过多孔离子传导膜
D. 由电池的电极反应可推出还原性:I->Br- >Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学学习过的一些气体可以用如图装置分别制取、干燥和收集,烧杯中的NaOH溶液用于吸收尾气。根据要求回答以下问题。

(1)请分析能用该装置制取、干燥、收集和吸收的气体对反应物、反应条件及气体性质必须符合的要求:
①对反应物的要求:____________;
②对反应条件的要求:___________;
③对生成气体性质的要求:___________。
(2)实验室用高锰酸钾和浓盐酸在如图装置中制取氯气。请回答:
①B中盛放的药品名称是_____;
②C中的现象是________;若C中出现______的现象时,说明反应中没有氯气生成。
③NaOH溶液的作用是_______,反应的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com