
| A. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | Na2S投入水中:S2-+2H2O?H2S+2OH- | |
| C. | 向含1molAlCl3溶液中投入4molNa:Al3++4Na+2H2O═AlO2-+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+3BaSO4↓ |
分析 A、NaClO溶液具有氧化性,能将SO2氧化;
B、多元弱酸盐分步水解;
C、钠先和盐中的水反应,然后生成的氢氧化钠再和氯化铝反应;
D、明矾溶液中铝离子和硫酸根离子的物质的量之比为1:2.
解答 解:A、NaClO溶液具有氧化性,能将SO2氧化,生成硫酸,不生成HSO3-,故A错误;
B、Na2S投入水中:S2-+H2O?HS-+OH-,故B错误;
C、钠先和盐中的水反应,然后生成的氢氧化钠再和氯化铝反应,即Al3++4Na+2H2O═AlO2-+4Na++2H2↑,故C正确;
D、明矾溶液中铝离子和硫酸根离子的物质的量之比为1:2,向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全时的反应为:Al3++2S042-+2Ba2++4OH-═[Al(OH)4]-↓+2BaSO4↓,故D错误.
故选C.
点评 本题考查离子方程式的书写,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握离子的反应必须符合反应的实际,注意电荷守恒和质量守恒问题,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关.SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
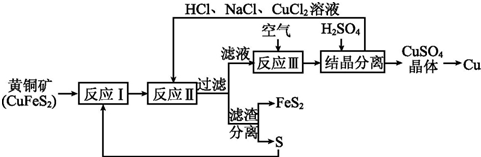
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其氢氧化物中碱性最强的是NaOH | B. | 单质还原能力最强的是钠 | ||
| C. | 单质的与水反应时钠最剧烈 | D. | 原子半径逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
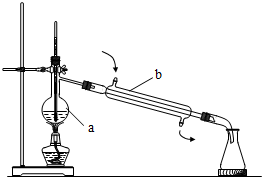 (1)写出如图所指仪器的名称:
(1)写出如图所指仪器的名称:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com