
下列物质分类的正确组合是
选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
B | NH3·H2O | 小苏打 | 氧化镁 | 二氧化氮 |
C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
科目:高中化学 来源:2016-2017学年广西桂林市高三上学期期中考化学试卷(解析版) 题型:选择题
除去括号内杂质所用试剂和方法,正确的是 ( )
A.苯(苯酚)浓溴水 过滤
B.乙烷(乙烯)通入氢气 催化加热
C.乙酸(乙醛)通入O2气 常温常压
D.乙酸乙酯(乙酸)饱和碳酸钠溶液 分液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如下图所示:

(1)则25 ℃时水的电离平衡曲线应为_________(填“A”或“B”),请说明理由 。
℃时水的电离平衡曲线应为_________(填“A”或“B”),请说明理由 。
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为__________.
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________.
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:选择题
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g) CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变
③各气体组分浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是 ( )
A.①②⑤ B.③④⑤ C.⑥⑦ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2017届宁夏银川市高三上学期第三次月考化学试卷(解析版) 题型:选择题
在50mL18mol·L-1的浓H2SO4中加入足量的Cu片并加热,充分反应后,被还原的H2SO4的物质的量为
A.等于0.9mol
B.等于0.45mol
C.大于0.45mol,小于0.9mol
D.小于0.45mol
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中质量检测化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是( )
A.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
C.用聚氯乙烯代替木材,生产包装盒、快餐盒等,以减少木材的使用
D.氢氧燃料电池、硅太阳能电池中都利用了原电池原理
查看答案和解析>>
科目:高中化学 来源:2017届河南省豫北推荐高三上学期精英对抗赛化学试卷(解析版) 题型:推断题
[化学——选修5:有机化学基础]酮洛芬是一种良好的非甾体抗炎镇痛药。下面是酮洛芬的中间体F的合成路线:
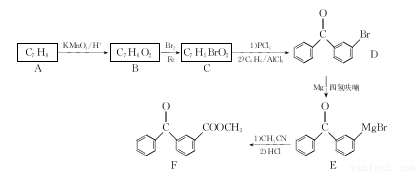
回答下列问题:
(1)A的结构简式为 ,F中含氧官能团名称为 。
(2)由A生成B的反应类型为 。
(3)由B生成C的化学方程式为 ,其反应类型为 。
(4)四氢呋喃是一种性能优良的溶剂,可由呋喃加氢得到。呋喃的结构简式为 ,则四氢呋喃的结构简式为 。
,则四氢呋喃的结构简式为 。
(5)W是C的同分异构体,W既能发生银镜反应,又能与FeCl3溶液发生显色反应,W的结构共有 种(不含立体结构);写出-种符合下列条件的F的同分异构体的结构简式: 。
①能与FeCl3发生为色反应
②核磁共振氢谱有6个吸收峰
(6)参照上述合成路线,以苯和CH3CN为起始原料,设计制备的 合成路线:
合成路线:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一上月考三化学卷(解析版) 题型:选择题
将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A.2:1:2 B.1:1:2 C.2:2:1 D.1:1:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学卷(解析版) 题型:简答题
(1)常温下,将1 mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中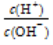 =________。
=________。
(2)某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11,则该温度下水的离子积常数KW=____________,该温度____________25 ℃。(填“>”、“=”或“<”)
(3) 在(2)所述温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合。若所得混合液的pH=10,则Va∶Vb=___________。
(4) 常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在答题卷的图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com