
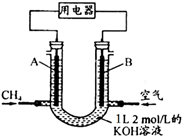
 将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL.
|
|
|
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当电池负极消耗m g气体时,电解池阳极同时有m g气体生成 |
| B、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| C、电池的负极反应式为:O2+2H2O+4e-═4OH- |
| D、电池中c(KOH)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室中用稀硫酸与锌粒反应制取H2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用H2O2与MnO2作用产生O2 |
| D、实验室中用稀盐酸与石灰石反应制取CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2Cl2的结构式为Cl-S-S-Cl |
| B、S2Cl2为含有极性键和非极性键的极性分子 |
| C、S2Br2与S2Cl2结构相似,熔沸点S2Cl2>S2Br2 |
| D、2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、②④⑤ |
| C、①②③⑤ | D、③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com