
| A. | 尼龙绳 | B. | 宣纸 | C. | 羊绒衫 | D. | 棉衬衣 |
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液除去锅炉中水垢(CaSO4):Ca2++CO32-═CaCO3↓ | |
| B. | 用惰性电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | B. | S2-的结构示意图: | ||
| C. | 过氧化氢的电子式:H+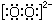 H+ H+ | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
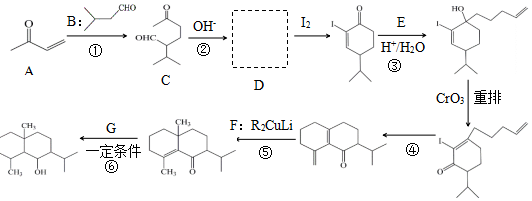
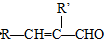 +H2O
+H2O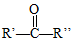 →
→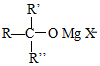 $\stackrel{H+/H_{2}O}{→}$
$\stackrel{H+/H_{2}O}{→}$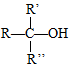

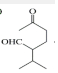 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$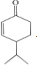 +H2O.
+H2O.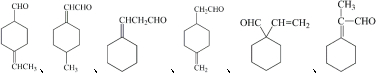
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,足量Fe与22.4 L Cl2反应,转移的电子数为2NA | |
| B. | 0.1molO2完全反应时,转移的电子数一定为 0.4 NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为 0.2NA | |
| D. | 常温常压下,100 g 17% H2O2水溶液中含氧原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2•xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
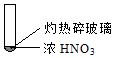 | 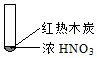 | 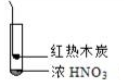 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
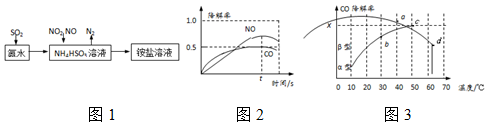
 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围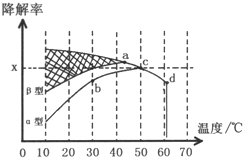 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com