

分析 图所示装置制备Na2S2O3,利用的原理是亚硫酸钠和浓硫酸反应生成二氧化硫气体,二氧化硫通过硫化钠和碳酸钠的混合溶液,发生反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3;
(1)①上述分析可知①中盛放试剂为Na2S 溶液、Na2CO3溶液;
②为避免污染气体二氧化硫排放到空气中,需要通过氢氧化钠溶液吸收;
(2)随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,继续通入气体沉淀会消失亚硫酸钠和硫单质反应生成硫代硫酸钠;
(3)溶液中得到溶质晶体的操作为加热浓缩,冷却结晶,过滤洗涤得到.
解答 解:图示装置制备Na2S2O3的原理,利用的是亚硫酸钠和浓硫酸反应生成二氧化硫气体,二氧化硫通过硫化钠和碳酸钠的混合溶液,发生反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3;
(1)①上述分析可知①中盛放试剂为生成硫代硫酸钠的装置,试剂应是Na2S 溶液、Na2CO3溶液,发生反应Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,Na2SO3+S=Na2S2O3,生成目标产物;
故答案为:Na2S 溶液、Na2CO3溶液;
②为避免污染气体二氧化硫排放到空气中,需要通过氢氧化钠溶液吸收,SO2+2NaOH=Na2SO3+H2O,②中盛放的试剂是氢氧化钠溶液,
故答案为:NaOH溶液;
(2)随着气体的通入,装置①中有气泡产生,还有大量黄色固体析出,Na2CO3+SO2=Na2SO3+CO2,2Na2S+SO2=3S+2Na2SO3,继续通入气体沉淀会消失,是因亚硫酸钠和硫单质反应生成硫代硫酸钠,Na2SO3+S=Na2S2O3,则观察到的现象为沉淀逐渐消失,
故答案为:沉淀逐渐消失;
(3)溶液中得到溶质晶体的操作为加热浓缩,冷却结晶,过滤洗涤得到,反应结束后,从制得的Na2S2O3稀溶液中得到Na2S2O3•5H2O晶体的主要操作包括加热浓缩,冷却结晶,过滤洗涤;
故答案为;加热浓缩,冷却结晶,过滤洗涤.
点评 本题考查了物质制备实验装置和原理的分析判断,主要是制备反应的过程理解应用,制备反应和实验基本操作是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOC2H5+H2O | |
| B. | H-C≡C-H+HCl$\stackrel{催化剂}{→}$H2C=CHCl | |
| C. |  +HNO3$→_{60℃}^{浓硫酸}$ +HNO3$→_{60℃}^{浓硫酸}$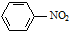 +H2O +H2O | |
| D. |  +Br2$\stackrel{FeBr_{3}}{→}$ +Br2$\stackrel{FeBr_{3}}{→}$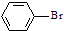 +HBr +HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
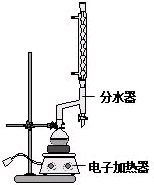 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
苯甲酸* | 无色、片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,由水电离出的氢离子浓度均为1×10-11 mol•L-1 | |
| B. | 分别加水稀释100倍后,两种溶液的pH仍相同 | |
| C. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| D. | 分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)基态铬原子的价电子排布式为3d54s1.
(1)基态铬原子的价电子排布式为3d54s1.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分:
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下图是元素周期表的一部分: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com