
【题目】合金ThNi5可催化反应CO(g)+3H2(g)=CH4(g)+H2O(g),在一定温度下,反应过程中有无催化剂的能量变化如图。下列叙述正确的是

A.使用催化剂时反应的速率主要决定于第②步
B.缩小体积可加快该反应速率,是因为增大了活化分子百分数
C.使用催化剂降低反应的焓变,降低温度有利于产物的生成
D.升高温度,平衡常数减小
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列有关说法中正确的是
A.60 g乙酸分子中所含共价键的数目为 8NA
B.标准状况下,11.2LCHCl3中含有的原子总数为2.5NA
C.高温下,1mol Fe与足量水蒸气反应,转移电子数的目为3 NA
D.将1molCl2通入水中,所得溶液中HClO、Cl-、ClO-粒子数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应时,每生成92g液态HCOOH放出62.4kJ的热量,下列说法正确的是( )

A.图示中物质II为该反应的催化剂
B.图示中参与循环的物质只有CO2和H2
C.反应的活化能为62.4kJ·mol-1
D.该反应的热化学方程式为H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
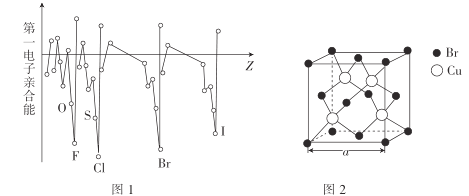
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由多元素组成的化合物Fe-Sm-As-F-O是一种重要的铁系超导材料。下列说法正确的是
A.F的核外电子排布式1s22s22p7
B.Fe3+的轨道表示式![]() 违背了泡利不相容原理
违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究温度对反应2H2S(g)![]() 2H2(g) +S2(g)的影响,兴趣小组进行如下探究:向三个体积均为2L的恒容密团容器(A1、A2、A3)中分别加入等量的H2S,进行H2S分解实验。在T1、T2、T3,下测得H2的物质的量与时间的关系如下图所示:
2H2(g) +S2(g)的影响,兴趣小组进行如下探究:向三个体积均为2L的恒容密团容器(A1、A2、A3)中分别加入等量的H2S,进行H2S分解实验。在T1、T2、T3,下测得H2的物质的量与时间的关系如下图所示:

(1)该反应的△H____0(填“>”“<”或“=”,下同),T2、T3温度下的平衡常数K2______K3。
(2)T1温度下,前5min用S2(g)表示的反应速率为_____。
(3)图中P、Q、M三点逆反应速率由小到大的顺序是_____。
(4)已知v正=k正c2(H2S),v逆=k逆c2(H2)c(S2), 温度为T1时,k逆=3.4k正。则该温度下的化学平衡常数的值为___(保留小数点后两位数字)。
(5)在A容器中,下列选项中能标志反应2H2S(g)![]() 2H2(g) +S2(g)达到平衡的是___(填写序号)。
2H2(g) +S2(g)达到平衡的是___(填写序号)。
a v正(H2S)=2v逆(S2) b H2和S2的浓度之比为2;1
c 密度不再变化 d 平均相对分子质量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O ![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-===CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的合成中间体,其合成路线如图所示: 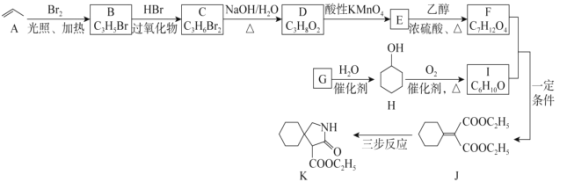
已知:①R1-NH2+R2-COOC2H5![]()
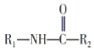 +C2H5OH(R表示烃基或氢原子);
+C2H5OH(R表示烃基或氢原子);
②R-CN ![]() R-CH2NH2(R表示烃基);
R-CH2NH2(R表示烃基);
③HBr与不对称烯烃加成时,在过氧化物作用下,则卤原子连接到含氢较多的双键碳上。
请回答下列问题:
(1)C的化学名称为_____。
(2)D→E的反应类型为_____,F中官能团的名称是_____。
(3)G→H的化学方程式为_____。
(4)J的分子式为________。手性碳原子是指与四个各不相同原子或基团相连的碳原子,则K分子中的手性碳原子数目为_____。
(5) L是F的同分异构体,则满足下列条件的L的结构简式为_________。(任写一种结构即可)
A. 1 mol L与足量的NaHCO3溶液反应能生成2 mol CO2;
B. L的核磁共振氢谱有3组峰且峰面积之比为1:2:3。
(6)请写岀J经三步反应合成K的合成路线:_____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com