
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )

A. 一元酸HA为弱酸
B. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C. pH=7时,c(Na+)>c(A-)+c(HA)
D. b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
【答案】C
【解析】a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,结合电荷守恒、物料守恒解答。
A.a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,A正确;
B.a点A-水解,溶液显碱性,但水解程度较小,则溶液中c(Na+)>c(A-)>c(OH-)>c(HA),B正确;
C.pH=7的溶液呈中性,溶液中c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),则有c(Na+)=c(A-),C错误;
D.b点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,根据电荷守恒和物料守恒可知c(H+)-c(OH-)=1/2[c(A-)-c(HA)],D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
(1)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 .
(2)25℃时,pH=3的CH3COOH溶液和pH=11的NaOH溶液混合,若所得溶液显酸性,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
(3)NaCN溶液中通入少量CO2 , 所发生反应的化学方程式为 .
(4)25℃时,pH=8的CH3COONa溶液中,c(Na+)﹣c(CH3COO﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种新型的绿色环保储能电池,其电池总反应为:V3++VO2++H2O ![]() VO2++2H++V2+ . 下列说法正确的是( )
VO2++2H++V2+ . 下列说法正确的是( )
A.放电时正极反应为:VO2++2H++e﹣=VO2++H2O
B.放电时每转移2mol电子时,消耗1mol氧化剂
C.充电过程中电子由阳极经导线移向阴极,再由阴极经电解质溶液移向阳极
D.放电过程中,H+由正极移向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锌原电池(如图)工作时,以下说法正确的是( ) ①电子流动方向从Zn﹣灯泡﹣Cu﹣盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.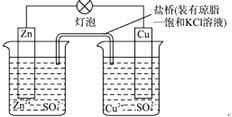
A.①②③
B.②④⑤
C.②③④
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列说法中错误的是
A.容量瓶不能用于溶解固体
B.容量瓶不能用于加热
C.容量瓶可以用来长期存放溶液
D.容量瓶可以用于配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A.0.1mol/LCH3COONa与0.1mol/LHCl溶液等体积混合:c(Na+)=c(Cl﹣)>c(OH﹣)>cCH3COO﹣)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3H2O)>c(NH4+)>c(Cl﹣)>c(OH﹣)
C.0.1mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合: ![]() c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
D.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42﹣)+c(HC2O4﹣)+c(OH﹣)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(资治通鉴·后晋高祖天福二年)有言:“闽主作紫微官,饰以水晶”。下列关于水晶主要成分的说法正确的是
A. 是一种硅酸盐 B. 分子式为SiO2
C. 是酸性氧化物,不溶于任何酸 D. 在高温条件下可与碳酸钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com