
【题目】(1)2017年5月,我国在南海成功开采“可燃冰”(甲烷水合物),标志着在技术方面取得了突破性进展。甲烷是优质的清洁能源,综合开发利用能有效缓解大气污染问题。
已知:CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1
H2O(g)=H2O(l) ΔH =- 44kJ·mol-1
则1mol CH4(g)不完全燃烧生成CO和H2O(l) 的热化学方程式为:___________________________。
(2)甲烷转化为CO和H2的反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH>0。
CO(g)+3H2(g) ΔH>0。
①一定条件下,CH4的平衡转化率与温度、压强的关系如下图1所示。则P1________P2(填“<”、“>”或“=”) ;A、B、C 三点处对应的平衡常数(KA、KB、KC)由大到小的顺序为___________________。
②将CH4和H2O(g)按等物质的量混合,一定条件下反应达到平衡,CH4转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为________________。
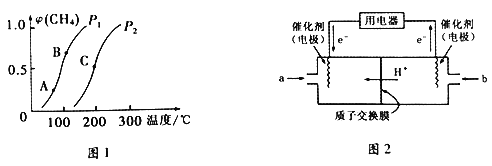
(3)甲烷燃料电池工作原理如上图2所示。a气体是______________,b气体通入电极的反应式为__________。用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,则燃料电池中理论上消耗CH4的体积(标准状况)为_________________。
(4)25℃时,H2CO3的电离常数分别为:Ka1=4.4×10-7mol·L-1;Ka2=5.0×10-11 mol·L-1。在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,所得溶液pH=8。此溶液中各阴离子的物质的量浓度大小关系为__________________,![]() =__________________。
=__________________。
【答案】 CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol < KC>KB>KA 3:2(或:1.5) O2(或氧气) CH4+2H2O-8e-===CO2+8H+ 1.68 L c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-) 或:c(CO32-)<c(OH-)<c(HCO3-)<c(Cl-) 200
【解析】(1)①CH4(g)+2O2(g)=CO2(g) +2H2O(g) ΔH =- 802 kJ·mol-1,②2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mol-1,③H2O(g)=H2O(l) ΔH =- 44kJ·mol-1,根据盖斯定律,将①-![]() ×②+③×2得:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=(- 802 kJ·mol-1)-(-566kJ·mol-1)×
×②+③×2得:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=(- 802 kJ·mol-1)-(-566kJ·mol-1)×![]() +(- 44kJ·mol-1)×2=-607 kJ/mol,故答案为:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol;
+(- 44kJ·mol-1)×2=-607 kJ/mol,故答案为:CH4(g)+3/2O2(g)===CO(g)+2H2O(l) ΔH=-607 kJ/mol;
(2)①根据CH4(g)+H2O(g)![]() CO(g)+3H2(g),相同温度下,增大压强,平衡逆向移动,CH4的平衡转化率减小,结合图像可知P1<P2;该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,A、B、C 三点处对应的平衡常数由大到小的顺序为KC>KB>KA,故答案为:<;KC>KB>KA;
CO(g)+3H2(g),相同温度下,增大压强,平衡逆向移动,CH4的平衡转化率减小,结合图像可知P1<P2;该反应为吸热反应,升高温度,平衡正向移动,平衡常数增大,A、B、C 三点处对应的平衡常数由大到小的顺序为KC>KB>KA,故答案为:<;KC>KB>KA;
②将CH4和H2O(g)按等物质的量混合,假设均为1mol,
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始(mol) 1 1 0 0
反应(mol) 0.5 0.5 0.5 1.5
平衡(mol) 0.5 0.5 0.5 1.5
平衡后气体的物质的量为3mol,平衡前后,气体的质量不变,则混合气体的平均相对分子质量之比=![]() :
:![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(3)根据电子的移动方向可知,右侧电极为负极,通入的气体为甲烷,左侧电极为正极,通入的气体为氧气,甲烷在负极上发生氧化反应生成二氧化碳,电极反应式为CH4+2H2O-8e-==CO2+8H+;用该燃料电池作电源、以石墨作电极电解硫酸铜溶液,一段时间后,若将0.1mol Cu2(OH)2CO3溶解于该溶液,恰好使溶液恢复至起始成分和浓度,说明电解生成的物质为:阴极上生成0.2molCu,0.1mol氢气,阳极上生成0.15mol氧气,转移电子0.15mol×4=0.6mol,则燃料电池中理论上消耗CH4的物质的量为![]() =0.075mol,标准状况下的体积为0.075mol×22.4L/mol =1.68 L,故答案为:O2;CH4+2H2O-8e-==CO2+8H+;1.68 L;
=0.075mol,标准状况下的体积为0.075mol×22.4L/mol =1.68 L,故答案为:O2;CH4+2H2O-8e-==CO2+8H+;1.68 L;
(4)在20mL0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液20mL,反应后的溶液中存在等浓度的NaHCO3和NaCl,浓度均为0.05mol/L,溶液pH=8,说明碳酸氢钠的水解程度大于电离程度,溶液显碱性,溶液中各阴离子的物质的量浓度大小关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);![]() =
=![]() =
=![]() =
=![]() =200,故答案为:c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);200。
=200,故答案为:c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-);200。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72﹣和CrO42﹣ , 它们会对人类及生态系统产生很H+①转化 Fe2+②还原 OH﹣③沉淀大的伤害,必须进行处理.常用的处理方法有还原沉淀法,该法的工艺流程为:CrO42﹣ ![]() Cr2O72﹣
Cr2O72﹣ ![]() Cr3+
Cr3+ ![]() Cr(OH)3其中第①步存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
Cr(OH)3其中第①步存在平衡:2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色.
(2)第②步中,还原1mol Cr2O72﹣离子,需要mol的FeSO47H2O.
(3)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是 . 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH﹣(aq)
(4)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH﹣)=10﹣32 , 要使c(Cr3+)降至10﹣5mol/L,溶液的pH应调至 .
(5)已知AgCl、Ag2CrO4(砖红色)的Ksp分别为2×10﹣10和1.12×10﹣12 . 分析化学中,测定含氯的中性溶液中Cl﹣的含量,以K2CrO4作指示剂,用AgNO3溶液滴定.滴定过程中首先析出沉淀 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人在配制某植物培养液时使用了NH4NO3、KNO3、CaCl2、MgSO4、微量元素溶液,但缺少了一种必需的元素,为补充这种元素,应添加的化合物是
A. Ca(NO3)2 B. KCl C. KH2PO4 D. K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用如图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转. 
请回答下列问题:
(1)甲池为(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为 .
(2)丙池中F电极为(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应的化学方程式为 .
(3)当池中D极质量增重10.8g时,甲池中B电极理论上消耗O2的体积为mL(标准状况).
(4)已知丙池中的溶液为400mL,合上开关K,一段时间后,丙池中,阳极共收集到气体224mL(标准状况下)气体,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
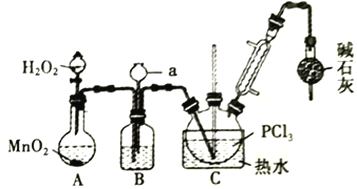
【题目】三氯化氧磷(POCl3)常用作半导体掺杂剂,实验室制取POCl3并测定产品质量的实验过程如下,据此回答下列问题:
Ⅰ.氧化液态PCl3法制备POCl3:
资料i:有关试剂的性质及实验装置(加热及夹持装置省略)如下:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 两者均为无色液体,相互溶解;遇水均剧烈水解为两种酸。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)A 中反应时,MnO2的作用是_________________;仪器a的名称为_________________;
(2)盛有浓硫酸的装置B,其作用除观察O2的流速之外,还有_________________;
(3)实验时应控制反应温度在60~65℃,温度不宜过高的原因是_________________;;如果撤去装有碱石灰的干燥管,则可能降低POCl3的产量,原因是_________________________________(用化学方程式表示,任写一个)。
Ⅱ.沉淀滴定法测定POCl3质量:
资料ii :Ag3PO4为黄色沉淀,易溶于硝酸;
iii:Ag++SCN-=AgSCN↓,且Ksp(AgSCN) <Ksp(AgCl)。
实验步骤如下:
①将三颈烧瓶中的产品POCl3去除杂质,溶于60.00mL蒸馏水中,搅拌使其完全水解,将水解液配成100.00mL溶液;
②取10.00mL溶液于锥形瓶中,加入10.00mL 3.8mol/L AgNO3标准溶液;
③加入少量硝基苯,用力摇动,使沉淀表面覆盖硝基苯;
④加入2~3 滴硫酸铁溶液作指示剂,用0.2mol/L KSCN溶液滴定过量的AgNO3溶液,到达终点时共用去10,00mL KSCN溶液。
(4)达到终点时的现象是______________________________;
(5)所得产品POCl3的质量为____________(结果保留两位小数);若取消步骤③,则所得结果将______________(填“ 偏高”、“ 偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C三种装置都可制取溴苯,请仔细分析三套装置,然后回答下列问题。
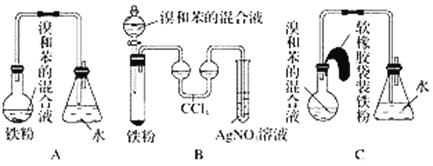
(1)写出三个装置中都发生反应的化学方程式_____________、________________;写出B的试管中还发生的反应的化学方程式__________________。
(2)装置A、C中长导管的作用是____________________________________________。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是_____________________,对C应进行的操作是__________。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是_______。
(5)B中采用了双球吸收管,其作用是_________________________________________;反应后双球管中可能出现的现象是___________________________;双球管内液体不能太多,原因是__________________________________________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行,这两个缺点是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com