
【题目】I.工业金属钛冶炼过程中有一步将原料金红石转化,其反应方程式为:TiO2(金红石)+2C+2Cl2=TiCl4+2CO
已知:
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1;
②2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1;
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141kJ·mol-1;
(1)CO的燃烧热是___。
(2)请写出金红石转化的热化学方程式___。
II.如图所示的三套实验装置中,甲、乙两套装置的电池反应均为Zn+Cu2+=Zn2++Cu,盐桥内装有含琼脂的饱和KCl溶液,回答下列有关问题:
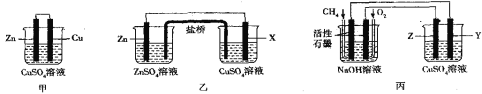
(1)甲装置中铜电极上的电极反应式为___。
(2)放电时盐桥中的Cl-将会出现在乙装置__(填“左”或“右”)侧的容器中,X电极的成分不可能是__(填字母)
a.铜 b.铁 c.石墨 d.铝
(3)用丙装置在铁上镀铜,则电极材料为铁的是__(填“Y或Z”),负极上的电极反应式为___。
(4)当丙池中某电极的质量减少1.6g时,则消耗的O2在标况下的体积是___。
【答案】283kJ/mol(或△H=-283 kJ/mol) TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g) △H=-80kJ/mol Cu2++2e-=Cu 左 d Y CH4+10OH--8e-=CO32-+7H2O 0.28L
【解析】
Ⅰ.(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
(2)依据热化学方程式和盖斯定律计算焓变,并写出热化学方程式;
Ⅱ.(1)Zn比Cu活泼,作负极,Cu作正极,据此写出正极反应式;
(2)在乙图装置中,Zn作负极、X作正极,盐桥中的Cl-将向负极移动;由Zn+Cu2+═Zn2++Cu可知,X电极活泼性需要小于Zn;
(3)丙装置中,左装置为碱性燃料电池,燃料甲烷所在电极为负极,通入O2的电极为正极,则右装置为电解池,Z电极为阳极,Y电极为阳极,铁上镀铜时 纯铜为阳极,铁作阴极,硫酸铜溶液作电解质;
(4)丙装置中,纯铜为阳极,铁作阴极,根据电子守恒得到关系式为2Cu~4e-~O2,阳极Cu电极减少1.6gCu时,物质的量为0.025mol,据此计算O2的物质的量和体积。
Ⅰ.(1)2CO(g)+O2(g)═2CO2(g)△H=-566kJmol-1,燃烧热的热化学方程式为:CO(g)+![]() O2(g)═CO2(g)△H=-283 kJ/mol,则CO燃烧热为283kJ/mol,故答案为:283kJ/mol(或△H=-283 kJ/mol);
O2(g)═CO2(g)△H=-283 kJ/mol,则CO燃烧热为283kJ/mol,故答案为:283kJ/mol(或△H=-283 kJ/mol);
(2)①C(s)+O2(g)═CO2(g)△H=-393.5kJmol-1,②2CO(g)+O2(g)═2CO2(g)△H=-566 kJmol-1,③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+141 kJmol-1,根据盖斯定律,将①×2-②+③得到:TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=(-393.5kJmol-1)×2-(-566 kJmol-1)+(+141 kJmol-1)=-80 kJ/mol,故答案为:TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=-80kJ/mol;
Ⅱ.(1)Zn比Cu活泼,Zn为负极,发生失去电子的氧化反应,Cu作正极,正极上Cu2+得电子生成Cu,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)在乙图装置中,Zn易失电子、作负极,X作正极,放电时盐桥中的Cl-将向负极移动,即向左移动,盐桥中的Cl-将会出现在左侧的容器中;由Zn+Cu2+═Zn2++Cu可知,X电极活泼性小于Zn,铜、铁、石墨的活泼性均小于Zn,不可能发生失去电子的反应,Al比Zn活泼,若X为Al,则Al作负极,原电池反应发生改变,故答案为:左;d;
(3)丙装置中,左侧装置为碱性燃料电池,燃料甲烷发生失去电子的氧化反应,所在电极为负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入O2的电极为正极,则右装置为电解池,Z电极为阳极,Y电极为阴极,在铁上镀铜时 纯铜为阳极,铁作阴极,即电极材料为铁的是Y,故答案为:Y;CH4+10OH--8e-=CO32-+7H2O;
(4)丙池为电解池,其中某电极的质量减少1.6g,是阳极Cu电极减少1.6g,物质的量为![]() =0.025mol,整个装置中关系式为2Cu~4e-~O2,n(O2)=
=0.025mol,整个装置中关系式为2Cu~4e-~O2,n(O2)=![]() n(Cu)=0.0125mol,在标况下的体积V=nVm=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L。
n(Cu)=0.0125mol,在标况下的体积V=nVm=0.0125mol×22.4L/mol=0.28L,故答案为:0.28L。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
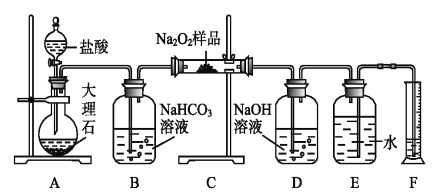
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为__________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为 _______________。 (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为________________________、______________________________、______________________________。检验溶液中Fe3+存在的试剂是_______________。
②写出FeCl3溶液与金属铜发生反应的化学方程式_____________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学有关的文献,理解正确的是
A. 《石灰吟》中“…烈火焚烧若等闲…要留清白在人间”,其中“清白”指氢氧化钙
B. 《咏煤炭》中“凿开混沌得乌金…不辞辛苦出山林”,其中“乌金”的主要成分是木炭
C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中的“碱”是一种盐溶液
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“丝”“麻”、“裘”主要成分均属于多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表列出了A~R9种元素在周期表中的位置,用化学用语回答:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
|
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)这九种元素中化学性质最不活泼的是___。
(2)D元素的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是__。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为__。
(4)F、G、H三种元素简单氢化物沸点由高到低的顺序__。/p>
(5)E元素氧化物的电子式是__,F的氢化物在常温下跟B反应的化学方程式是__。
(6)下列事实能用元素周期律解释的是(填字母序号)__。
A.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
B.G的气态氢化物的稳定性弱于HF
C.FeG3的溶液可用于刻蚀铜制的印刷电路板
(7)G的单质可以从NaBr溶液中置换出Br2单质,从原子结构的角度解释其原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。关于下列各实验装置图的叙述中正确的是( )
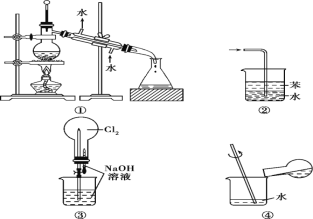
A. 装置①常用于分离互不相溶的液态混合物
B. 装置②可用于吸收氨气,且能防止倒吸
C. 用装置③不可以完成“喷泉”实验
D. 用装置④稀释浓硫酸和铜反应冷却后的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,配制一组c(PO43-)+c(HPO42-)+c(H2PO4-)+c(H3PO4)=0.100 mol·L-1的H3PO4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
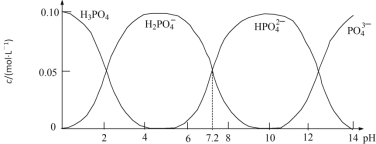
A.pH=6的溶液中:c(H3PO4)+c(HPO42-)>c(H2PO4-)
B.c(Na+)=0.100mol·L-1的溶液中:c(H3PO4)=2c(PO43-)+c(HPO42-)
C.pH =7的溶液中:c(Na+)>2c(HPO42-)+c(H2PO4-)
D.c(H3PO4)=c(H2PO4-)的溶液中:c(Na+)<0.100mol·L-1 +2c(PO43-)+c(HPO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是

A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com