
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态氯化氢 | D. | 熔融的KOH |
分析 在水溶液里或熔融状态下能导电的化合物是电解质;能导电的物质中含有自由电子或自由移动的阴阳离子;单质、混合物不是电解质,据此即可解答.
解答 解:A.MgCl2晶体没有自由移动的离子不导电;在水溶液里或熔融状态下的MgCl2晶体能完全电离出自由移动的阴阳离子而使其导电,所以MgCl2晶体是电解质,因不导电,故A错误;
B.氯化钠溶液中有自由移动的钠离子和氯离子,能导电;但氯化钠溶液是水和氯化钠组成的混合物,不是电解质,故B错误;
C.液态氯化氢,是纯净物,只有氯化氢分子不导电;氯化氢的水溶液中,氯化氢能完全电离出氢离子和氯离子,所以是电解质,但不导电,故C错误;
D.熔融的KOH是化合物,能电离出自由移动的钠离子和氯离子,能导电,属于电解质,故D正确;
故选D.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,混合物不是电解质进行解题,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料完全燃烧不会造成大气污染 | |
| B. | CaCl2•6H2O可做袋装食品的干燥剂 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 可用Na2CO3治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
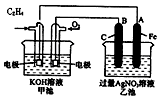 如图是一个化学过程的示意图,请根据该示意图完成下列题目:
如图是一个化学过程的示意图,请根据该示意图完成下列题目:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
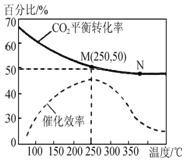 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com