
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如上图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为_____________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式________。
形式存在,写出相应反应的离子方程式________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:

分析40 ℃时TiO2·xH2O转化率最高的原因________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为_______。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成? ________(列式计算)。
沉淀生成? ________(列式计算)。![]() 的Ksp分别为
的Ksp分别为![]()
(6)写出“高温煅烧②”中由![]() 制备
制备![]() 的化学方程式___________。
的化学方程式___________。
【答案】100℃、2h,90℃、5h FeTiO3+ 4H++4Cl = Fe2++ TiOCl42- + 2H2O 低于40℃,TiO2·xH2O转化反应速率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化速率下降 4 Fe3+恰好沉淀完全时,c(PO43-)=![]() mol·L1=1.3×10–17 mol·L1,
mol·L1=1.3×10–17 mol·L1,
c3(Mg2+)×c2(PO43-)=(0.01 mol·L1)3×(1.3×10–17 mol·L1)2 =1.69×10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。 2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑
2LiFePO4+ H2O↑+ 3CO2↑
【解析】
(1)观察题(1)中的图可以看出,浸出率为70%时有2个点满足,一个点为100![]() 、2h,另一个点为90
、2h,另一个点为90![]() 、5h;
、5h;
(2)反应物为FeTiO3,因为酸浸,故反应物应有H+,因生成物为TiOCl42-,根据原子守恒和电荷守恒配平该氧化还原反应;
(3)结合化学反应速率、双氧水和氨水受热不稳定的性质综合分析转化率。
(4)Li2Ti5O15中Ti的化合价为+4,Li的化合价为+1,O的化合价为-2,过氧根(O22-)中氧元素显-1价,过氧键存在于-1价的O中,每2个![]() 之间存在1个过氧键,设该分子内过氧键的数目为x,根据化合物中各元素代数和为0分析作答;
之间存在1个过氧键,设该分子内过氧键的数目为x,根据化合物中各元素代数和为0分析作答;
(5)先根据Ksp[FePO4]计算出Fe3+恰好沉淀完全时,溶液中的PO43-的浓度,再结合Mg2+和PO43-的离子浓度商Qc[Mg3(PO4)2]与溶度积Ksp[Mg3(PO4)2]之间的大小关系,判断是否有沉淀生成;
(6)根据流程图知反应物为FePO4、Li2CO3、H2C2O4,生成物为LiFePO4,根据各元素化合价情况结合原子守恒规律分析作答;
(1)由图可知,铁的浸出率在70%时,所采用的实验条件是:利用盐酸在100![]() 下浸出2小时或利用盐酸90
下浸出2小时或利用盐酸90![]() 下浸出5小时,
下浸出5小时,
故答案为:100℃、2h,90℃、5h;
(2)反应物为FeTiO3,因为酸浸,故反应物应有H+,因生成物为TiOCl42-,因此反应物中还应有Cl-,然后根据原子守恒和电荷守恒配平,得到离子方程式为FeTiO3+ 4H++4Cl = Fe2++ TiOCl42-+ 2H2O,
答案为:FeTiO3+ 4H++4Cl = Fe2++ TiOCl42-+ 2H2O;
(3)一方面,温度低于40![]() 时,随温度升高,化学反应速率加快,另一方面,温度高于40
时,随温度升高,化学反应速率加快,另一方面,温度高于40![]() 时,氨水挥发速率加快、双氧水分解速度加快,导致反应物浓度减小,结果转化率降低,
时,氨水挥发速率加快、双氧水分解速度加快,导致反应物浓度减小,结果转化率降低,
故答案为:低于40℃,TiO2·xH2O转化反应速率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化速率下降;
(4)Li/span>2Ti5O15中Ti的化合价为+4,Li的化合价为+1,O的化合价位-2价,过氧根(O22-)中氧元素显-1价,设过氧键的数目为x,根据正负化合价代数和为0,可得(+1)![]() 2+(+4)
2+(+4)![]() 5+(-2)
5+(-2)![]() (15-2x)+(-1)
(15-2x)+(-1)![]() 2x = 0,解得x = 4,
2x = 0,解得x = 4,
故答案为:4;
(5)由Ksp[FePO4] = c(Fe3+)·c(PO43-)得,Fe3+恰好沉淀完全时,溶液中的PO43-的浓度c(PO43-) = ![]() mol/L= 1.3
mol/L= 1.3![]() 10-17 mol/L,则Mg2+和PO43-离子浓度商Qc[Mg3(PO4)2] = c3(Mg2+)·c2(PO43-) = (0.01 mol/L)3
10-17 mol/L,则Mg2+和PO43-离子浓度商Qc[Mg3(PO4)2] = c3(Mg2+)·c2(PO43-) = (0.01 mol/L)3![]() (1.3
(1.3![]() 10-17)2 = 1.69
10-17)2 = 1.69![]() 10-40
10-40![]() Ksp[Mg3(PO4)2],故不会生成Mg3(PO4)2沉淀,
Ksp[Mg3(PO4)2],故不会生成Mg3(PO4)2沉淀,
答案为:Fe3+恰好沉淀完全时,c(PO43-)=![]() mol·L1=1.3×10–17 mol·L1,
mol·L1=1.3×10–17 mol·L1,
c3(Mg2+)×c2(PO43-)=(0.01 mol·L1)3×(1.3×10–17 mol·L1)2 =1.69×10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀。
(6)根据流程图知反应物为FePO4、Li2CO3、H2C2O4,生成物为LiFePO4,各元素化合价情况为为![]() ,
,![]() ,
,![]() ,故Fe化合价降低,C化合价升高,可知产物之一为CO2,反应物有H原子,故产物有H2O,方程式为:2FePO4 + Li2CO3+ H2C2O4
,故Fe化合价降低,C化合价升高,可知产物之一为CO2,反应物有H原子,故产物有H2O,方程式为:2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑,
2LiFePO4+ H2O↑+ 3CO2↑,
故答案为:2FePO4 + Li2CO3+ H2C2O4![]() 2LiFePO4+ H2O↑+ 3CO2↑。
2LiFePO4+ H2O↑+ 3CO2↑。


科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅的叙述正确的是
A.硅在常温下能跟氧气发生化合反应
B.硅是组成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位
C.硅的化学性质不活泼,在常温下不与任何物质反应
D.硅在电子工业中是重要的半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧是人类最早利用的化学反应之一,人类已有几十万年的利用燃烧反应的历史,燃烧需要具备的条件是( )
①可燃物 ②氧气(空气等助燃剂) ③温度达到着火点
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强 合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中 制备金属钼的主要流程图。
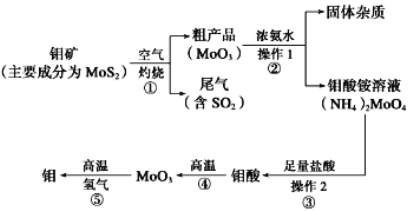
(1)写出在高温下发生反应①的化学方程_________________________________________
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:______________________________
(3)如果在实验室模拟操作 1 和操作 2,则需要使用的主要玻璃仪器有______________________________
(4)某同学利用下图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:
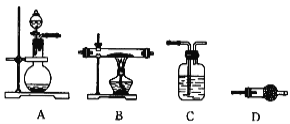
① 请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是______________________________
② 在烧瓶 A 中加入少量硫酸铜的目的是_____
③ 两次使用 D 装置,其中所盛的药品依次是_____、_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):
M2+(g)+CO32-(g) ![]() M2+(g)+O2(g)+CO2(g)
M2+(g)+O2(g)+CO2(g)
![]()
![]()
![]()
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是
A. ΔH1(MgCO3)>ΔH1(CaCO3)>0
B. ΔH2(MgCO3)=ΔH2(CaCO3)>0
C. ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO)
D. 对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四个图像,以下反应中完全符合上述图像的是( )

A. N2(g) +3H2 (g) ![]() 2NH3 (g) △H<O
2NH3 (g) △H<O
B. 2SO3 (g) ![]() 2SO2 (g) +O2 (g) △H>O
2SO2 (g) +O2 (g) △H>O
C. 4NH3 (g) +5O2 (g) ![]() 4NO (g) +6H2O (g) △H<O
4NO (g) +6H2O (g) △H<O
D. CO2(g) +NO(g) ![]() CO(g)+NO2(g) △H>O
CO(g)+NO2(g) △H>O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置的说法中正确的是
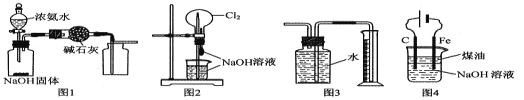
A. 图 1 装置可制取干燥纯净的 NH3
B. 图 2 装置可以完成“喷泉”实验
C. 图 3 装置可测量 Cu 与浓硝酸反应产生气体的体积
D. 图 4 装置可用于实验室制备 Fe (OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com