
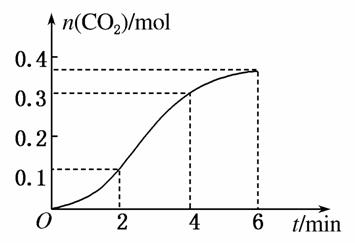
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )
A.反应开始4 min内温度对反应速率的影响比浓度大
B.一段时间后,反应速率减小的原因是c(H+)减小
C.反应在2~4 min内平均反应速率最大
D.反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
航天技术中使用的氢氧燃料电池具有高能、轻便和无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均为2H2+O2===2H2O。酸式电池中的电解质是酸,其负极反应可表示为2H2-4e-===4H+,则其正极反应可表示为____________________________________________;
碱式电池中的电解质是碱,其正极反应式为O2+2H2O+4e-===4OH-,则其负极反应可表示为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO 、NO
、NO 的相互分离。相应的实验过程可用下图表示:
的相互分离。相应的实验过程可用下图表示:
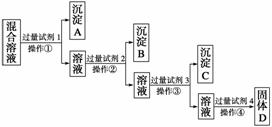
(1)写出上述实验过程中所用试剂的名称:试剂1为______________,试剂2为______________。
(2)控制试剂4的加入量的方法是__________________________。
(3)加入过量试剂3的目的是__________________________________。
(4)操作①的名称是________,在加入试剂4后,获得固体D的实验操作④是______________________(填操作名称)。
(5)写出加入试剂4后发生反应的化学方程式:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A+2B===3C+2D,在不同条件下的反应速率如下,其中最快的是( )
A.v(A)=0.3 mol·(L·s)-1
B.v(B)=0.9 mol·(L·s)-1
C.v(C)=0.6 mol·(L·s)-1
D.v(D)=0.8 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:

加入0.1 mol MnO2粉末于50 mL一定浓度的过氧化氢溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
(1)实验时放出气体的总体积是________。
(2)放出 气体所需时间为________。
气体所需时间为________。
(3)反应放出 气体所需时间约为________。
气体所需时间约为________。
(4)A、B、C、D各点反应速率快慢的顺序为_______________。
(5)解释反应速率变化的原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知当NH4Cl溶液的浓度小于0.1 mol·L-1时,其pH>5.1。现用0.1 mol·L-1的盐酸滴定10 mL 0.05 mol·L-1的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是( )
A.10 mL B.5 mL C.大于5 mL D.小于5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol·L-1的盐酸与等体积水混合后pH=1
D.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com