
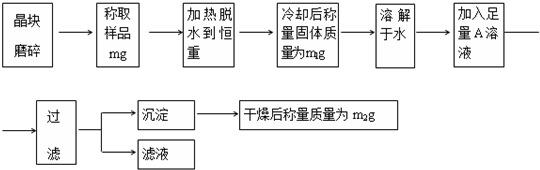
| W2g |
| 233g/mol |
| 142W2 |
| 233 |
| 142W2 |
| 233W1 |
| 142W2 |
| 233W1 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.20 | 24.00 |
| 第三次 | 10.00 | 0.40 | 21.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
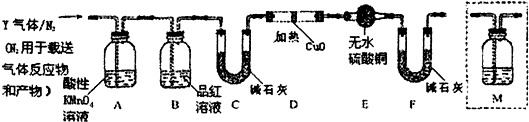
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 再投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:6 | B、6:1 |
| C、1:5 | D、5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
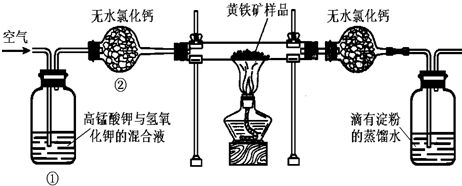
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中滴入盐酸产生的气体能使澄清石灰水变浑浊,则溶液中含有CO32- |
| B、向某溶液中滴入KSCN溶液变为血红色,则溶液中一定含有Fe3+ |
| C、向某溶液中滴加硝酸酸化的BaCl2溶液,若产生白色沉淀,则溶液中一定含有SO42- |
| D、某溶液中通入CO2产生白色沉淀,则溶液中一定含有SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com