
【题目】在0.1 mol/L的Na2CO3溶液中,下列关系式正确的是( )
A.c(Na+)=2c(CO32-)B.c(H+)>c(OH-)
C.c(CO32-)+c(HCO3-)=0.1mol/LD.c(HCO3-)<c(OH-)
【答案】D
【解析】
A.Na2CO3在溶液中存在CO32-水解,即CO32-+H2O![]() HCO3-+OH-,所以c(Na+)>2c(CO32-);故A错误;
HCO3-+OH-,所以c(Na+)>2c(CO32-);故A错误;
B.Na2CO3在溶液中存在CO32-水解,即CO32-+H2O![]() HCO3-+OH-,由于CO32-水解溶液呈碱性,所以c(OH-)>c(H+),故B错误;
HCO3-+OH-,由于CO32-水解溶液呈碱性,所以c(OH-)>c(H+),故B错误;
C.由于Na2CO3在溶液中存在着下列平衡:CO32-+H2O![]() HCO3-+OH-;HCO3-+H2O
HCO3-+OH-;HCO3-+H2O![]() H2CO3+OH-;所以Na2CO3在溶液中C的存在形式为CO32-、HCO3-、H2CO3,根据物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=0.1mol/L,故C错误;
H2CO3+OH-;所以Na2CO3在溶液中C的存在形式为CO32-、HCO3-、H2CO3,根据物料守恒:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=0.1mol/L,故C错误;
D.由于CO32-水解,水解方程式为CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O=H2CO3+OH-,所以c(OH)>c(HCO3-),故D正确;
HCO3-+OH-,HCO3-+H2O=H2CO3+OH-,所以c(OH)>c(HCO3-),故D正确;
所以答案:D。


科目:高中化学 来源: 题型:
【题目】二氧化氯![]() 是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制取
是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制取![]() 的工艺流程图.下列有关说法正确的是
的工艺流程图.下列有关说法正确的是
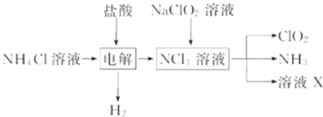
A.电解时发生反应的化学方程式为:2HCl![]() Cl2
Cl2![]() +H2
+H2![]()
B.由NaClO2溶液制取0.6molClO2时,至少消耗0.1molNCl3
C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3
D.溶液X的成分为NaClO2和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列实验现象的说法不正确的是

A. 氨气是无色有刺激性气味的气体,密度比空气小
B. 实验1,由喷泉现象可知氨气极易溶于水且溶解速率快
C. 实验1,烧瓶溶液中的含氮微粒有:NH3、NH3·H2O和NH4+
D. 实验2,加热过程中温度和c(NH3·H2O)对NH3·H2O电离平衡移动方向的影响一致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CH3COOH和NH3·H2O的电离常数均为1.8×10-5。向20 mL浓度均为0.1 mol/L NaOH和NH3·H2O的混合液中滴加等物质的量浓度的CH3COOH溶液,所得混合液的导电率与加入CH3COOH溶液的体积(V)的关系如图所示。下列说法不正确的是

A. a=20,b=40,且溶液呈中性处于A、B两点之间
B. B点溶液中:c(CH3COO-)>c(Na+)>c(NH![]() )
)
C. 已知lg3≈0.5,则C点的pH≈5
D. A、B、C三点中,B点溶液中水的电离程度最大
查看答案和解析>>
科目:高中化学 来源: 题型:
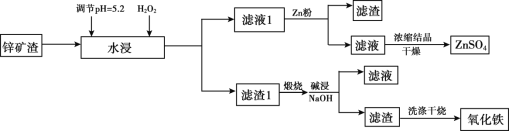
【题目】已知锌矿渣中含有ZnSO4、FeS2、SiO2、FeSO4、CuSO4 等,利用锌矿渣生产硫酸锌和氧化铁流程如下:
4FeS2+11O2  2Fe2O3+8SO2
2Fe2O3+8SO2
已知:i.FeS2不溶于水和稀酸。
ii.金属离子氢氧化物开始沉淀和沉淀完全时的pH
氢氧化物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 6.5 | 7.5 | 2.2 |
沉淀完全时的pH | 8.5 | 9.5 | 3.5 |
iii.SiO2难溶于水,可溶于强碱生成一种可溶性盐。
(1)加入H2O2的目的是________。
(2)检验滤液1中不含Fe3+的方法是________,滤液1加入锌粉的作用是_____________(用离子方程式表示)。
(3)滤渣1的成分主要有 _________(写化学式),加入NaOH碱浸时反应的离子方程式是__________。
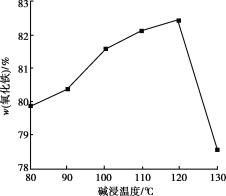
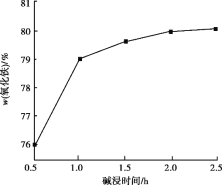
(4)用NaOH进行碱浸时,氧化铁含量与碱浸温度、碱浸时间关系如图所示,碱浸的最佳温度和时间为__________。
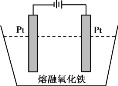
(5)传统钢铁冶炼高耗能、高污染,科学家寻找绿色环保的钢铁冶炼技术,通过电解的方法将铁矿石中的氧化铁(熔融态)变成金属铁。电解的示意图如图所示,请在图中标出两极名称及离子运动方向___________,并写出阴极电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行如下反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+2CO2(g),△H=-373.2kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:某二元酸H2XO4在水中电离分两步:H2XO4=H++HXO4-,HXO4-![]() H++XO42-。常温下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法错误的是( )
H++XO42-。常温下,在20mL0.1molL-1NaHXO4溶液中滴加cmolL-1NaOH溶液,溶液温度与溶液体积关系如图所示。下列说法错误的是( )
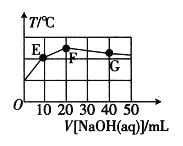
A.该NaOH溶液的pH=13
B.滴加过程中,水的电离程度先变大,后变小
C.F点溶液中c(OH-)>c(HXO4-)
D.G点溶液中c(Na+)=3c(H2XO4)+3c(HXO4-)+3c(XO42-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com