
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
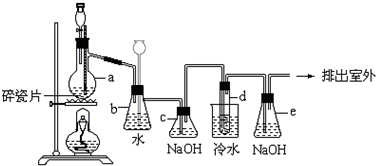
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率 | |
| B. | 压强增大不影响化学反应速率 | |
| C. | 冬天气温低,反应速率降低,对人类危害减小 | |
| D. | 无论外界条件怎样改变,均对此化学反应的速率无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于制备硅胶和木材防火剂 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 煤的气化是物理变化,是高效、清洁地利用煤的重要途径 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
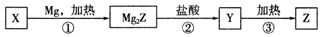
| A. | X可以和氢氟酸反应 | |
| B. | 甲烷的稳定性比Y强 | |
| C. | Z是将太阳能转换为电能的常用材料 | |
| D. | 上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2+2Y2?XY2 | B. | 3X2+Y2?2X3Y | C. | 2X2+Y2?2X2Y | D. | X2+3Y2?2XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
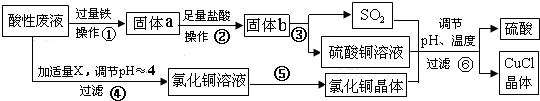
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com