
【题目】B、C、N是几种常见的非金属元素,其形成的各种化合物在自然界中广泛存在。

(1)基态硼原子的电子排布式为_________;C、N元素原子的第一电离能由大到小的顺序为_________;
(2)BF3与一定量的水可形成如图1的晶体R。
①晶体R中各种微粒间的作用力涉及_________(填字母);
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②R中阴离子的空间构型为_________;
(3)乙二胺(H2N-CH2-CH2-NH2)与CaCl2溶液可形成配离子(结构如图2)乙二胺分子中氮原子的杂化类型为_________;乙二胺和三甲胺[N(CH3)3]均属于铵,但乙二胺比三甲胺的沸点高得多,原因是__________________;
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,其结构与石墨相似,具有层状结构,可作高温润滑剂;它的晶体结构如图3所示,六方相氮化硼质地软的原因是__________________。
【答案】(1)1s22s22p1 N>C (2)abce 四面体 (3)sp3杂化 乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键 (4)层与层之间通过范德华力结合在一起,作用力小,导致其质地软
【解析】
试题分析:(1)硼原子核外有5个电子,其核外电子排布式为:1s22s22p1,同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,且第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N二种元素的第一电离能由大到小的顺序为:N>C ;
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软。


科目:高中化学 来源: 题型:
【题目】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成α萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:________________。
(2)B的分子式为______;写出一个同时满足下列条件的B的链状同分异构体的结构简式: ____。
①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
(3)B→C的反应类型分别为__________________。
(4)C→D的化学方程式为_______________________。
(5)试剂Y的结构简式为_________________。
(6)G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式: __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列关于生活中的一些做法不科学的是 ( )
A.用SO2漂白纸浆和草帽
B.Al(OH)3用于治疗胃酸过多
C.用小苏打发酵面团制作馒头
D.用较浓的氢氧化钠溶液洗涤衣服上的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是
CO(g)+3H2(g);ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是

A.0到5 min内,v(H2)=0.1 mol·(L·min)-1
B.反应进行到12min时,CH4的转化率为25%
C.恒温下,缩小容器体积,平衡后H2浓度减小
D.10 min时,改变的外界条件可能是升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0kJ·mol-1和726.5 kJ·mol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔盐,阴极最后只剩下纯钛。阴极的电极反应式为__________,石墨电极的质量是否发生变化 ___________ (填“是”或“否”)。

(3)常温下甲酸K=1×10-4。20.00mL0.1000mol·L-1NaOH溶液与一定量等物质的量浓度甲酸溶液混合后所得溶液中c(HCOOH)=c(HCOO-),该溶液c(H+)=________mol·L-1,所用甲酸的体积 ____40.00mL(填“>”、“<”或“=”),溶液中离子浓度由大到小的顺序为________________。
(4)已知Ksp(BaSO4)=1.1×10-10,若向50.00 mL0.009 mol·L-1 Ba(NO3)2溶液中加入50.00 mL 0.010mol·L-1稀硫酸,混合后溶液中c(Ba2+)=_________ mol·L-1,pH=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)=2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________。
(5)已知: ①N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量。
b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SOCl2(亚硫酰氯)是一种无色或淡黄色发烟液体,遇水或醇分解成二氧化硫和氯化氢,用途广泛。已知:SO2+Cl2+SCl2=2SOCl2。
(1)SCl2的电子式为_____________________;
(2)上述SOCl2的制备反应中,生成1molSOCl2时转移_______mol电子。
(3)SOCl2与足量NaHCO3溶液反应的离子方程式为_____________________;
(4)无水AlCl3是有机反应的催化剂,也是制备无水四氯铝酸锂(LiAlCl4)的原料,可由AlCl3溶液浓缩结晶得到AlCl3·6H2O,再脱水得到AlCl3。
①若将AlCl3溶液蒸发至干并充分灼烧,则最终得到的固体产物为______________(填化学式)。
②AlCl3·6H2O中加入SOCl2并加热可制得无水氯化铝。SOCl2的作用是________________________________(用文字和方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排列规律,判断空格中烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
A.C7H18 B. C7H14 C.C8H18 D.C8H16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液。下列有关叙述正确的是
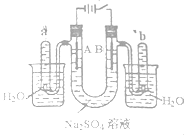
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com