
【题目】纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:

已知:① 生成氢氧化物沉淀时溶液的pH如下表:
物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________(填写两种);
(2)反应1中发生反应的离子方程式为______________,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______mol/L;
(3)反应2中加适量氨水的目的是_________,此时所需pH的范围为_________,当调节溶液pH=5时,溶液中的c(Fe3+)=__________;
(4)反应3的离子方程式为__________,反应类型为__________;
(5)从滤液B中可回收的主要物质是__________;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________。
【答案】适当增加酸的浓度、加热、将固体原料粉碎等2Fe2++H2O2+2H+=2Fe3++2H2O11.3调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去3.2≤pH<5.24.0×10—11mol/LZn+Cu2+ =Zn2++Cu置换反应(NH4)2SO42
【解析】(1)酸浸时,为了提高浸出率,可采取的措施有适当增加酸的浓度、加热、将固体原料粉碎等,故答案为:适当增加酸的浓度、加热、将固体原料粉碎等;
(2)反应1中,双氧水将溶解生成的硫酸亚铁氧化,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;根据c=![]() =
=![]() =11.3 mol/L,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;11.3;
=11.3 mol/L,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;11.3;
(3)根据生成氢氧化物沉淀时溶液的pH,反应2中加适量氨水可以调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去,此时所需pH的范围为3.2≤pH<5.2,当调节溶液pH=5时,溶液中的c(Fe3+)=![]() =
=![]() =4.0×10—11mol/L,故答案为:调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去;3.2≤pH<5.2;4.0×10—11;
=4.0×10—11mol/L,故答案为:调节溶液pH,使Fe3+完全转化成Fe(OH)3沉淀而除去;3.2≤pH<5.2;4.0×10—11;
(4)反应3中加入的锌与溶液中的铜离子发生置换反应,反应的离子方程式为Zn+Cu2+ =Zn2++Cu,故答案为:Zn+Cu2+ =Zn2++Cu;置换反应;
(5)根据流程图,滤液B中含有生成的(NH4)2SO4和过量的碳酸氢铵,因此可回收的主要物质是(NH4)2SO4,故答案为:(NH4)2SO4;
(6)焙烧Zna(OH)bCO3生成氧化锌、水蒸气和二氧化碳。16.2g氧化锌,生成的二氧化碳和水蒸气是质量为22.4g-16.2g=6.2g。
Zna(OH)bCO3![]() aZnO+
aZnO+![]() H2O+CO2
H2O+CO2
65a+17b+60 81a 9b+44
22.4g 16.2g 6.2g
则![]() =
=![]() =
=![]() ,解得a=2,b=2,故答案为:2。
,解得a=2,b=2,故答案为:2。


科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,合成轮烷的基本原料有CH2C12、丙烯、戊醇、苯,下列说法不正确的是

A. CH2C12有两种同分异构体
B. 丙烯能使溴水褪色
C. 戊醇在一定条件下能与乙酸发生酯化反应
D. 苯与足量氢气在镍催化作用下会发生加成反应生成环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解CO(NH2)2(尿素)的碱性溶液制氢气的装置如图所示(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极)。下列说法不正确的是
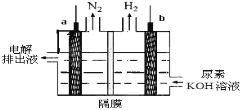
A.电解时,a极发生氧化反应
B.溶液中OH-逐渐向a极移动
C.电解时a极的电极反应式为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
D.若在a极产生标况下224mL N2,则消耗尿素2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的 |
Z | 第三周期原子半径最小的金属元素 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W B. Z的氧化物中含有非极性共价键
C. 离子半径:Z>W D. 最高价氧化物对应水化物的酸性:Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池被广泛应用于电动汽车的动力来源,下列说法不正确的是( )
A. 负极通入甲醇
B. 正极通入氧气或空气
C. 无污染物质生成
D. 甲醇燃料电池的能量利用率比甲醇燃烧的能量利用率小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中能大量共存的是( )。
A. 无色溶液中:K+、Na+、MnO4-、SO42-
B. 酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl-
C. 加入Al能放出H2的溶液中:HCO3-、NO3-、Mg2+、Na+
D. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——物质结构与性质】
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个电子;C的基态原子2p能级有1个电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式________。基态A原子的第I电离能比B的大,其原因是____。
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是_________。
(3)A的最简单氢化物分子的空间构型为___________,其中A原子的杂化类型是_________。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为_________,加入乙醇的目的是____________。
②写出该配合物中配离子的结构简式___________。
(5)C和D形成的化合物的晶胞结构如图所示,则D的配位数是_______,已知晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,求晶胞边长a=________cm(含用ρ、NA的计算式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com