
 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第七列元素 |
| F是第29号元素 |
| 5-1×3 |
| 2 |
| ||
| 2 |
| 2 |
| 2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 64 |
| NA |
| 2 |
| 64 |
| NA |
| 3 |
| ||||
| 3 |
| ||||


科目:高中化学 来源: 题型:
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )| A、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
| B、b点对应的溶液中大量存在:NH4+、K+、Cl-、NO3- |
| C、d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
| D、a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜-锌-稀硫酸组成的原电池中,锌为正极 |
| B、铜-锌-稀硫酸组成的原电池中,电解质溶液的质量逐渐减轻 |
| C、用石墨电极电解CuCl2溶液时,阳极上Cu2+放电而析出金属铜 |
| D、用石墨电极电解CuCl2溶液时,电解质溶液的浓度逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) |
1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A、等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
| B、amol?L-1HCN溶液与amol?L-1NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+),c(Na+)>c(CN-) |
| C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
| D、NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某种兴奋剂的结构简式如图:回答下列问题:
某种兴奋剂的结构简式如图:回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
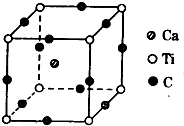 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 分类标准 | 含氧酸 | 分散系 | |
| 不属于该类别的物质 | Na2CO3 |
| 分类标准 | 能导电的物质 | 电解质 | 强电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:
W、X、Y、Z、R为前四周期元素且原子序数依次增大.W与Y形成常温下呈液态的化合物G,X可以spm(m=1,2,3)杂化方式与X形成一系列X的化合物,X的单质在高温条件下与G反应生成W单质和气态化合物;W的单质与Z的单质在点燃或光照时均能反应生成1:1的水溶液为常见的酸;R原子的价电子层的未成对电子数为4.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B、厨房中燃气泄漏,立即打开抽油烟机排气 |
| C、硝酸是重要的工业原料,可用于制造炸药 |
| D、高纯硅可用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com