
分析 (1)根据石(Al6Si2O13)中铝的质量分数的计算方法来回答;
(2)用1mol Al6Si2O13和 4mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,可以得出反应的方程式为:4SiO2+Al6Si2O13+8Na2CO3=5Na2SiO3+5NaAlO2+8CO2↑+NaAlSiO4;
(3)1kg粉煤灰含莫来石(Al6Si2O13)的质量433g,其物质的量1.016mol,根据粉煤灰中Al6Si2O13与 SiO2的物质的量之比为1:2,求SiO2物质的量为2.032mol,莫来石(Al6Si2O13))生成NaAlO2用第一个方程式的计量数关系求的为4.064mol,由SiO2制的NaAlO2为2.032mol,所以可制得NaAlO25.09mol;
(4)根据化学方程式进行相应的计算即可.
解答 解:(1)粉煤灰中铝的质量分数为43.4%×$\frac{27×6}{27×6+28×2+16×13}$×100%=16.5%,故答案为:16.5%;
(2)用1mol Al6Si2O13和 4mol SiO2制得5mol NaAlO2、1mol NaAlSiO4,可以得出反应的方程式为:4SiO2+Al6Si2O13+8Na2CO3=5Na2SiO3+5NaAlO2+8CO2↑+NaAlSiO4,故答案为:5;8;
(3)1kg粉煤灰含莫来石(Al6Si2O13)的质量433g,其物质的量1.016mol,根据粉煤灰中Al6Si2O13与 SiO2的物质的量之比为1:2,求SiO2物质的量为2.032mol,莫来石(Al6Si2O13))生成NaAlO2用第一个方程式的计量数关系求的为4.064mol,由SiO2制的NaAlO2为2.032mol,所以可制得NaAlO25.09mol,故答案为:5.09;
(4)设n(NaAlSiO4)=a;n(NaAlO2)=b
由Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑
1 3 2 4
0.5a 1.5a a 2a
再由 Al6Si2O13+5Na2CO3=2Na2SiO3 +6NaAlO2+5CO2↑
1 5 2 6
(100-0.5a) (500-2.5a) (200-a) (600-3a)
这时b=2a+(600-3a)=600-a
则x=$\frac{a}{600-a}$
a=$\frac{600x}{1+x}$,再由题意,
y=1.5a+(500-2.5a)=500-a=500-$\frac{600x}{1+x}$,
化简得y=$\frac{500-100x}{1+x}$,故答案为:$\frac{500-100x}{1+x}$.
点评 本题是一道关于金属以及化合物知识的相关计算题,考查学生分析和解决问题的能力,难度大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图 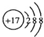 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| X | 最外层电子数是次外层的2倍 |
| Y | 元素主要化合价为-2价 |
| Z | 其单质及化合物的焰色为黄色 |
| M | 与X同主族,其单质为半导体材料 |
| N | 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
 ;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.
;Z2Y2中所含化学键类型是离子键和非极性共价键;XY2与Z2Y2反应的化学方程式是2CO2+2Na2O2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BrCH2CH2CH2CH2CH2Br | B. | 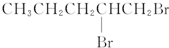 | ||
| C. | 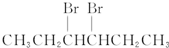 | D. | CH3CH2CH2CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com