
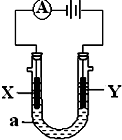
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:分析 (1)若X、Y都是惰性电极,a是饱和NaCl溶液,Y电极上氯离子放电生成氯气,氯气可以用湿润的淀粉碘化钾试纸检验,X电极上氢离子放电,同时该电极附近生成氢氧根离子;
(2)①要在铁件的表面镀铜防止铁被腐蚀,铁为阴极,铜为阳极,电解质溶液为硫酸铜;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,根据析出铜质量和转移电子之间的关系式计算;
③作原电池负极的金属易被腐蚀.
解答 解:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,所以该电极附近氢氧根浓度增大,碱性增强,滴入几滴酚酞试液会变红,
①Y电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,
故答案为:2Cl--2e-=Cl2↑;酚酞变红,有气泡产生;
②X电极上氢离子放电,同时该电极附近生成氢氧根离子,Y电极上氯离子放电生成氯气,所以电池反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;
(2)①要在铁件的表面镀铜防止铁被腐蚀,铁为阴极,铜为阳极,阳极发生Cu-2e-=Cu2+,电解质溶液为硫酸铜,电解过程中其浓度不变,
故答案为:纯铜;Cu-2e-=Cu2+;CuSO4;不变;
②电镀时,阳极上金属失电子导致金属质量减少,阴极上析出金属,导致质量增加,电镀后两极质量差的一半为阴极上析出的铜质量,所以阴极上析出铜的质量=5.12g×$\frac{1}{2}$=2.56g,转移电子的物质的量=$\frac{2.56g}{64g/mol}$=0.08 mol,
故答案为:0.08;
③铜、铁和电解质溶液构成的原电池中,铁作负极而加速被腐蚀,铁、锌和电解质溶液构成的原电池中,铁作正极被保护,所以镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,
故答案为:铁比铜活泼,镀层破坏后,在潮湿的环境中形成原电池,加速铁的腐蚀.
点评 本题考查电解池知识,为高频考点,侧重于学生的分析能力和计算能力的考查,本题涉及电极反应式的书写、检验等知识点,知道离子放电顺序及电极反应式的书写方法,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为1.0mol•L-1 | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.018mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 加入试剂 | 离子方程式 |
| NH4Cl(AlCl3)溶液 | ||
| NaHCO3(Na2CO3)溶液 | ||
| Fe 粉(Al粉) | ||
| FeCl3(FeCl2)溶液 |
 15.(18分)
15.(18分) ,反应类型是加聚反应.
,反应类型是加聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生氧化反应的为负极 | B. | 正极为电子流入的一极 | ||
| C. | 比较不活泼的金属为负极 | D. | 电流的方向由正极到负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
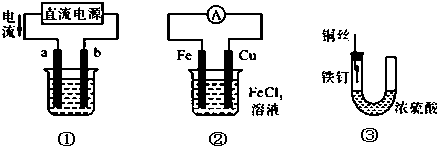
| A. | 用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 用装置①进行电镀,镀件接在b极上 | |
| C. | 装置②的总反应是:Cu+Fe3+═Cu2++Fe | |
| D. | 装置③中的铁钉几乎没被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com