
分析 (1)工业上用氯气与氢氧化钙反应制备漂白粉,二者反应生成氯化钙、次氯酸钙和水;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(3)氢氧化钙少量,反应生成碳酸钙、碳酸钠和水;
(4)硫酸氢钠与氢氧化钡按照物质的量之比为2:1反应生成硫酸钡、硫酸钠和水,溶液呈中兴.
解答 解:(1)工业上用氯气与氢氧化钙反应制备漂白粉,二者反应生成氯化钙、次氯酸钙和水,方程式:
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:4HCl(浓)+MnO₂$\frac{\underline{\;加热\;}}{\;}$MnCl₂+Cl₂↑+2H₂O;
故答案为:4HCl(浓)+MnO₂$\frac{\underline{\;加热\;}}{\;}$MnCl₂+Cl₂↑+2H₂O;
(3)氢氧化钙少量,反应生成碳酸钙、碳酸钠和水,离子方程式:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O;
故答案为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O;
(4)硫酸氢钠与氢氧化钡按照物质的量之比为2:1反应生成硫酸钡、硫酸钠和水,离子方程式:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
故答案为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;
点评 本题考查了化学方程式、离子方程式的书写,明确相关物质的性质是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶于稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 盐酸与硝酸银溶液反应:Cl-+Ag+═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25℃时,pH=7的NH4Cl与NH3•H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 实验测得NH4HCO3溶液显碱性,CH3COONH4溶液显中性,说明酸性:CH3COOH>H2CO3 | |
| D. | 0.01 mol•L-1Na2CO3溶液与0.01 mol•L-1NaHCO3溶液等体积混合:3[c(CO32-)+c(HCO3-)+c(H2CO3)]=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①④ | B. | 仅①③ | C. | 仅②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
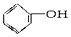 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH.
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH.| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
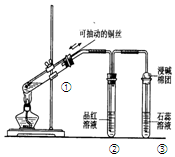
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液褪色 | |
| C. | ③中石蕊溶液变红色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯的物质的量共1 mol,其混合物完全燃烧生成3 mol H2O | |
| D. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷元素是生命体中重要的元素之一
磷元素是生命体中重要的元素之一查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com