
| ||
| ||
| 冰晶石 |
| ||
| 冰晶石 |
| ||


科目:高中化学 来源: 题型:
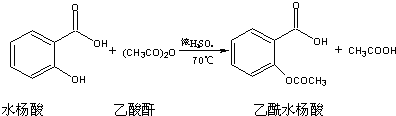

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 产品中不含Na2SO4 | ||
| ③ | 向试管C中, | 产品中不含水杨酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周 族 期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KCl溶液 |
| B、NaOH溶液 |
| C、稀H2SO4 |
| D、Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X中不能确定的离子是 A13+、Na+、K+和C1- |
| B、气体F经催化氧化可直接生成气体D |
| C、沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 |
| D、X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸与甲酸甲酯互为同分异构体 | ||||
B、
| ||||
| C、氧气与臭氧互为同素异形体 | ||||
| D、乙烯与聚乙烯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
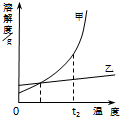
| A、t1℃时,物质的量浓度:甲=乙 |
| B、温度变化相同时,溶解度数值的变化量:甲>乙 |
| C、t2℃时,饱和溶液中溶质的质量分数:甲=乙 |
| D、相同质量的饱和溶液由t2℃降到t1℃时,析出的固体:甲<乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com