将含过量氧气和乙烯及某烷烃组成的混合气体20L,点燃爆炸反应后,气体体积仍为20L(120℃,1.01×105Pa),然后将气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L.求烷烃的分子式及原来乙烯的体积.
【答案】
分析:先根据混合气体在点燃爆炸反应后气体体积不变求出烷烃的分子式;根据碱石灰能吸收水和二氧化碳,但不能吸收多余的氧气,所以剩余两升为过量的氧气,求出反应生成CO
2和H
2O的体积,浓硫酸只能吸收水分,求出最后剩余的气体的成分,最后设CH
4为xL,C
2H
4 为yL,通过化学方程式求出生成CO
2和H
2O,列方程组便可解得.
解答:解:根据C
2H
4+3O
2→2CO
2+2H
2O可知,在120℃101kPa下气体的体积是保持不变的,也就是说烷烃也应该如此,设烷烃的化学式为C
xH
2x+2,则其燃烧的化学方程式为C
xH
2x+2+
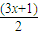
O
2→xCO
2+(x+1)H
2O,也即满足1+

=x+x+1,解得x=1,即烷烃的化学式为CH
4;
碱石灰能吸收水和二氧化碳,但不能吸收多余的氧气,所以剩余两升为过量的氧气,
反应生成CO
2和H
2O的体积共18L,浓硫酸只能吸收水分,最后剩余的体积中含有过量的2L氧气和8L生成的二氧化碳,所以反应中还生成了10L的H
2O.
设CH
4为xL,C
2H
4 为yL,通过化学方程式可知分别生成CO
2 xL、2yL,分别生成H
2O 2xL,2yL,
列方程组x+2y=8;2x+2y=10,解得x=2L,y=3L.
故烷烃的分子式为CH
4及原来乙烯的体积为2L.
答:烷烃的分子式为CH
4及原来乙烯的体积为2L.
点评:本题主要考查了化学计算,在确定气体的成分是要抓住燃烧前后气体体积不变的反应中有机物分子中的氢原子数为4.

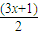 O2→xCO2+(x+1)H2O,也即满足1+
O2→xCO2+(x+1)H2O,也即满足1+ =x+x+1,解得x=1,即烷烃的化学式为CH4;
=x+x+1,解得x=1,即烷烃的化学式为CH4;

 黄冈创优卷系列答案
黄冈创优卷系列答案 所有碳原子一定在同一平面上
所有碳原子一定在同一平面上