
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
【答案】C
【解析】
A、氯气是有毒气体不能直接排放到空气中,G装置中的氢氧化钠溶液能与氯气反应而除去多余氯气,防止空气污染,选项A正确;B、因为AlCl3易水解,所以铝和氯气反应必须在干燥的环境下进行,因此装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中,选项B正确;C、用50mL12mol/L的盐酸与足量的MnO2反应,由于浓盐酸不断消耗,变为稀盐酸,与二氧化锰不反应,所以50mL12mol/L的盐酸产生氯气的量小于0.15mol,因此氯气与铝反应生成氯化铝的量少于0.1 mol,质量小于13.35g,选项C错误;D、实验过程中应先点燃A处的酒精灯,反应产生氯气,利用氯气排净装置内的空气,待装置中充满黄绿色气体时再点燃D处的酒精灯,反应进行,选项D正确;答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
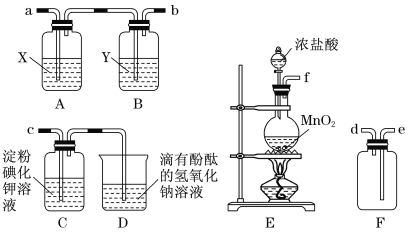
请回答下列问题:
(1)整套实验装置的连接顺序是f接( ) ( )接( )( )接( )(各接口处的字母代号)。_________
(2)E装置中制取氯气的离子方程式是_________________________。
(3)B装置的作用是__________________;A装置中试剂X是________________。
(4)C装置中可观察到的现象是____________。
(5)ClO2和氯气具有相似的性质,用如图装置可以测定某混合气中ClO2 的含量:(其他成分不参与反应)
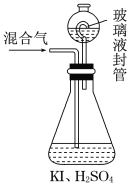
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入3 mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0 mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂
显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
A. 锥形瓶内ClO2与碘化钾反应的离子方程式为__________________________________。
B. 测得混合气中ClO2的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ/mol。
2NO2(g) ΔH=+24.4 kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是 _________。
a.v正(N2O4)=2v逆(NO2)
b.体系颜色不变
c.气体平均相对分子质量不变
d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,混合气体颜色____(填 “变深”“变浅”或“不变”),判断理由_______。
(2)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数[例如:p(NO2)=p总×x(NO2)]。写出上述反应平衡常数Kp表达式 _______________________(用p总、各气体物质的量分数x表示);影响Kp的因素_________________。
(3)上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,则Kp为____(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当N2O4分解10%时,v正=______________kPa·s-1。
(4)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
B. 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸钠溶液中红色更深,证明阴离子水解常数Kh: CO32->HCO3-
C. 含0.2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为0.3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、现象、结论等均正确的是( )

A. a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸
B. b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好
C. c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO
D. d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证Ksp(AgCl)>Ksp(Ag2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列陈述I、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 干燥的氯气有强氧化性 | 氯水能使有色布条褪色 |
B | SO2是酸性氧化物 | SO2可使含有酚酞的NaOH溶液褪色 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | 用淀粉-KI溶液鉴别FeCl2 | Fe2+有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的分类正确的是( )
A. 氯水、水玻璃、明矾都是混合物
B. CO2、NO2、P2O5均为酸性氧化物
C. 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
D. 根据分散系粒子直径的大小将分散系分为溶液、胶体和浊液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com