
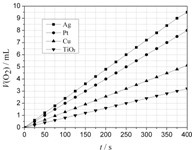
 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
| 0.008L |
| 22.4L/mol |
| ||
| 0.008L |
| 22.4L/mol |
| 3.57×10-4mol |
| 400s |
| ||


科目:高中化学 来源: 题型:
| A、标准状况下,22.4L NO和22.4L O2的混合,混合气体中含有的氧原子数为3NA | ||||
| B、0.012kg 13C中,含中子数为7NA | ||||
| C、25℃时,1L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子 | ||||
D、在反应3SiO2+6C+2N2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B两元素能形成多种化合物 |
| B、D、E两元素的最高价氧化物对应的水化物可相互反应 |
| C、C的气态氢化物的稳定性一定大于F的气态氢化物 |
| D、C、F两种元素可以形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含NA个氧原子的O2 |
| B、标准状况下2.24LN2 |
| C、0.5molCH4 |
| D、22gCO2(CO2摩尔质量为44g?mol-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol?Lˉ1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | A | B |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 反应能量变化 | 放出αkJ热量 | 吸收19.6kJ热量 |

查看答案和解析>>
科目:高中化学 来源: 题型:
A、A的结构简式为: |
| B、A→天然橡胶的反应类型为加聚反应 |
| C、天然橡胶属于线型高分子化合物 |
| D、天然橡胶具有热固性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com