汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)
2CO
2(g)+N
2(g)△H=a kJ?mol
-1.
为了测定在某种催化剂作用下该反应的反应速率,t
1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如表1(CO
2和N
2的起始浓度为0).
表1
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/×10-4mol?L-1 |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
| c(CO)/×10-3mol?L-1 |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是
反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率v(N
2)=
;t
1℃时该反应的平衡常数K=
.
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是
.
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
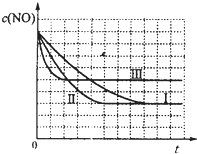
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据表2设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 实验编号 |
T/℃ |
NO初始浓度/mol?L-1 |
CO初始浓度/mol?L-1 |
催化剂的比表面积/m2?g-1 |
| ① |
350 |
1.20×10-2 |
5.80×10-2 |
124 |
| ② |
280 |
1.20×10-2 |
5.80×10-2 |
124 |
| ③ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为
.
(5)已知:N
2(g)+O
2(g)=2NO(g)△H
1=+180.5kJ?mol
-1 2C(s)+O
2(g)=2CO(g)△H
2=-221.0kJ?mol
-1C(s)+O
2(g)=CO
2(g)△H
3=-393.5kJ?mol
-1则处理汽车尾气反应中的a=
.
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g)?N
2(g)+CO
2(g)△H
4.向某密闭容器加入一定量的活性炭和NO,在t
2℃下反应,
有关数据如表3.
|
NO |
N2 |
CO |
| 起始浓度mol.L-1 |
0.10 |
0 |
0 |
| 平衡浓度/mol.L-1 |
0.04 |
0.03 |
0.03 |
平衡后升高温度,再次达到平衡测得容器中NO、N
2、CO
2的浓度之比为5:3:3,则△H
4
O(填“>”、“=”或“<”).







 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径. CO+3H2
CO+3H2 CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.
CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如上左图所示.