
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
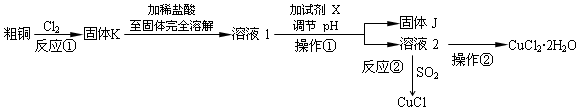
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体,据此分析(1)~(4);
(5)依据方程式中各反应物量之间的关系计算CuCl的纯度,CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,CuCl~Ce4+,所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去.
(6)①Cu与Cl2反应产生大量棕黄色烟(CuCl2);
②正极上ClO-得电子生成Cl-.
解答 解:(1)CuCl中铜元素+1价;氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O;
故答案为:+1价;加少量盐酸,蒸发浓缩、冷却结晶,过滤,洗涤,干燥;
(2)用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去;
故答案为:c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuCl↓+4H++SO42-;
(4)由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存;
故答案为:避光、密封保存;
(5)根据题目中所给数据及平行实验结果相差不能超过1%,体积为24.35mL,误差大舍去,滴定0.25g样品消耗硫酸铈标准溶液的平均体积为24mL,结合方程式可知:CuCl+FeCl3═CuCl2+FeCl2,CuCl的纯度为24×10-3L×0.1 mol•L-1×99.5g•mol-1÷0.25g×100%=95.5%;
故答案为:95.5%;
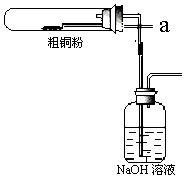
(6)①Cu与Cl2反应产生大量棕黄色烟(CuCl2),则反应时盛粗铜粉的试管中的现象是产生大量棕黄色烟;
故答案为:产生大量棕黄色烟;
②反应后,盛有NaOH溶液的广口瓶中生成NaClO溶液,该溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,ClO-得电子作正极生成Cl-,则正极上的电极方程式为:ClO-+2e-+H2O=Cl-+2OH-;
故答案为:ClO-+2e-+H2O=Cl-+2OH-.
点评 本题考查了实验室制备氯化铜和氯化亚铜,涉及物质的制备实验操作、除杂质、离子方程式的书写、氧化还原滴定、原电池原理的应用等,题目涉及的知识点较多,侧重于基础知识的综合应用的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 122.5 g KClO 3中含Cl-数目为NA | |
| B. | 1 mol/L的NaOH溶液中含Na+数目为NA | |
| C. | 标准状况下,22.4 L水中含氢原子数目为2NA | |
| D. | 常温常压下,32 g S03中含氧原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称2-硝基甲苯(邻硝基甲苯).
的名称2-硝基甲苯(邻硝基甲苯).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用的氢氧化钠固体放置于空气中过久 | |
| B. | 定容时,眼睛俯视刻度线 | |
| C. | 洗涤烧杯和玻璃棒的溶液未转入容量瓶中 | |
| D. | 定容后摇匀,发现液面低于刻度线,不作处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O+O2+4e-=4OH- | B. | Fe-2e-=Fe2+ | ||
| C. | 2H++2e-=H2↑ | D. | Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| Al2O3 | Na2O2 | Si | Na2SiO3 |
| 两性氧化物 | 碱性氧化物 | 单质 | 硅酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com