
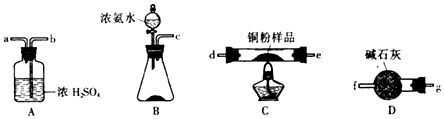
分析 (1)①根据氨气还原氧化铜反应的原理测定某铜粉样品(混有CuO粉未)中金属铜的含量,通过测定反应生成水的质量来达到实验目的,需要测定反应生成的水的质量,生成氨气通过碱石灰干燥,再通入装置C加热氨气和氧化铜反应生成铜、氮气和水蒸气,通过装置D吸收生成的水蒸气,最后通过装置A吸收未反应的氨气,防止空气中水蒸气进入装置D;
②装置B中固体试剂为氢氧化钠或碱石灰或氧化钙,遇到浓氨水溶解放热一水合氨分解生成氨气;
③分析可知装置A的作用吸收未反应的氨气,防止空气中水蒸气进入装置D;
④向锥形瓶中逐滴滴加浓氨水,把装置中空气排出后再加热反应,防止铜被氧气氧化;
(2)①利用上述装置通过测定反应前后装置C中固体的质量变化来达到实验目的,利用B装置生成氨气,通过装置D中碱石灰干燥氨气,通过装置C氨气和氧化铜反应,最后通过浓硫酸吸收过量氨气;
②测得反应前装置C的质量为m2g,充分反应后装置C的质量为m3g,结合化学方程式定量关系计算氧化铜质量,计算得到铜的质量分数;
(3)要测定铜的质量分数,铜和稀盐酸不反应,氧化铜和稀盐酸反应,即可求出铜的质量分数.设计方案的主要步骤是将样品与稀盐酸充分反应后,过滤、洗涤、干燥,称量剩余固体铜的质量、计算即可,反应的化学方程式为CuO+2HCl═CuCl2+H2O.
解答 解:(1)①根据氨气还原氧化铜反应的原理测定某铜粉样品(混有CuO粉未)中金属铜的含量,通过测定反应生成水的质量来达到实验目的,需要测定反应生成的水的质量,生成氨气通过碱石灰干燥,再通入装置C加热氨气和氧化铜反应生成铜、氮气和水蒸气,通过装置D吸收生成的水蒸气,最后通过装置A吸收未反应的氨气,防止空气中水蒸气进入装置D,按气流方向连接各仪器接口,顺序为c g f d e(或ed)gf b a,
故答案为:c g f d e(或ed)gf b a;
②装置B是利用固体和液体反应,不需要加热,装置中固体试剂为氢氧化钠或碱石灰或氧化钙,遇到浓氨水溶解放热,一水合氨分解生成氨气,
故答案为:氢氧化钠或氧化钙或碱石灰;
③装置A中浓硫酸的作用为:吸收未反应的氨气;防止外界空气进入后面的装置D中,
故答案为:吸收未反应的氨气,防止外界空气进入后面的装置D中;
④加热反应管,向锥形瓶中逐滴滴加浓氨水两部操作步骤顺序是:先向锥形瓶中逐滴滴加浓氨水,再加热,若先加热反应管,铜粉会被空气中的氧气氧化,造成测定误差,
故答案为:ii;若先加热反应管,铜粉会被空气中的氧气氧化,造成测定误差;
(2)①利用上述装置通过测定反应前后装置C中固体的质量变化来达到实验目的,利用B装置生成氨气,通过装置D中碱石灰干燥氨气,通过装置C氨气和氧化铜反应,最后通过浓硫酸吸收过量氨气,按气流方向连接各装置,顺序为BDCA,
故答案为:BDCA;
②测得反应前装置C的质量为m2g,充分反应后装置C的质量为m3g,结合化学方程式定量关系计算氧化铜质量,
3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O△m
3 mol 48g
n (m2-m3)g
n=$\frac{3({m}_{2}-{m}_{3})}{48}$mol,
样品中铜的质量分数=$\frac{{m}_{1}g-\frac{3({m}_{2}-{m}_{3})}{48}mol×80g/mol}{{m}_{1}g}$×100%=$\frac{{m}_{1}-({m}_{2}-{m}_{3})×\frac{80}{16}}{{m}_{1}}$×100%,
答:样品中金属铜的质量分数表达式为 $\frac{{m}_{1}-({m}_{2}-{m}_{3})×\frac{80}{16}}{{m}_{1}}$×100%;
(3)设计一个测定样品中金属铜含量的实验方案是利用铜和稀盐酸不反应,氧化铜和盐酸反应,取一定质量的铜粉样品;加入过量的稀盐酸充分溶解反应;过滤、洗涤;干燥、称量、计算,
答:取一定质量的铜粉样品,加入过量的稀盐酸充分溶解反应,过滤、洗涤、干燥、称量、计算.
点评 本题考查了物质含量的测定,涉及实验基本操作、气体除杂、物质含量的测定等知识点,明确实验原理是解本题关键,实验基本操作是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 84消毒液的有效成分是NaClO | |
| B. | 装饰材料释放的甲醛会造成污染 | |
| C. | 高纯硅广泛应用于太阳能电池和计算机芯片 | |
| D. | 食品/保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石膏的化学式:2CaSO4•H2O | B. | 明矾的化学式:KAlSO4•12H2O | ||
| C. | 氨分子的结构式: | D. | NH4H的电子式: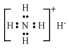 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 铜溶于硫酸酸化的H2O2溶液:Cu+2H++H2O2═Cu2++2H2O | |
| C. | 少量SO2通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| D. | 向A12(SO4)3溶液中加少量Ba(OH)2溶液:Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
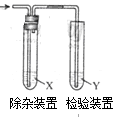 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯 的制备 | 试剂X | 剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
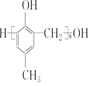 )的合成路线如图:
)的合成路线如图: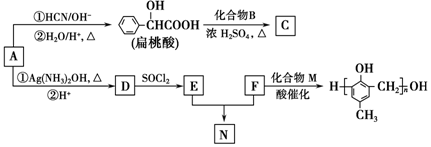
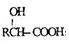
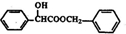 .
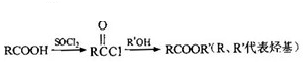
. )有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基和亚甲基(-CH2-)的同分异构体共有3种,写出其中一种同分异构体的结构简式 (任意一种)..
(任意一种)..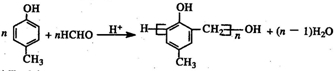
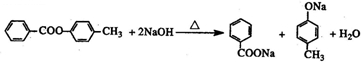 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内消耗amolB,同时生成3amolA | |
| B. | 容器内压强不再变化 | |
| C. | 单位时间内消耗3amolA,同时生成4amolC | |
| D. | 3v(A)=v(B)=4v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因浓硫酸具有强氧化性,故不可用它来干燥氢气 | |
| B. | 浓硫酸可用铁铝容器存放是因为常温下浓硫酸不与这两种金属反应 | |
| C. | 浓硫酸有强氧化性,稀硫酸不具有氧化性 | |
| D. | 实验室中利用浓硫酸的高沸点性来制备HCl等气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com