

分析 过氧化氢为液体,难以贮存和运输,工业常见过氧化氢转化为过碳酸钠,生成时将反应温度控制在0~5℃,目的是防止在较低温度下2Na2CO3•3H2O2溶解度更小,且过氧化氢和过碳酸钠较稳定,加入稳定剂,发生MgCl2+Na2SiO3=MgSiO3↓+2NaCl,不溶物将过碳酸钠粒子包住,由于2Na2CO3•3H2O2具有Na2CO3和Na2O2的双重性质;
(1)过氧化氢受热易分解,浓缩过程中要采取措施降低温度,通常可用降低溶液沸点的方法;
(2)过氧化氢中的氧完全转化为氧气,是氧化过程,需要添加氧化剂,可选择的氧化剂为酸性条件下的高锰酸钾溶液,结合电子守恒、电荷守恒及原子守恒来配平相应的离子方程式;
(3)过氧化氢不稳定,而过碳酸钠晶体稳定且易保存和运输;过碳酸钠在异丙醇中的溶解度较小;
(4)在低温时H2O2与2Na2CO3•3H2O2稳定(不易分解)且2Na2CO3•3H2O2的溶解度小;
(5)根据元素守恒可书写化学方程式.
解答 解:(1)为防止过氧化氢的分解,通常采用减压蒸馏的方法来浓缩7%~8%的氧化氢溶液为30%的溶液,故答案为:减压蒸馏;
(2)利用酸性的高锰酸钾溶液氧化过氧化氢得到氧气,发生反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;故答案为:5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O;
(3)过氧化氢为液体,且在在一定条件下可发生分解,难以贮存和运输,溶液加入异丙醇后可得到过碳酸钠晶体,说明过碳酸钠在异丙醇中的溶解度较小,易与分离,
故答案为:为了贮存运输和使用的方便;降低过碳酸钠的溶解度,有利于晶体的析出;
(4)生成时将反应温度控制在0~5℃,目的是防止在较低温度下2Na2CO3•3H2O2溶解度更小,且过氧化氢和过碳酸钠较稳定,
故答案为:低温下H2O2与2Na2CO3•3H2O2稳定,2Na2CO3•3H2O2溶解度更小;
(5)稳定剂发生MgCl2+Na2SiO3=MgSiO3↓+2NaCl,不溶物将过碳酸钠粒子包住,
故答案为:MgCl2+Na2SiO3=MgSiO3↓+2NaCl;
点评 本题考查物质制备的实验设计,侧重于钠的化合物的性质及氧化还原反应理论的考查,注意把握制备原理,结合题给信息解答,答题时注意审题,要具备较强的审题能力和自学能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 某反应的△H>0、△S<0,则该反应一定不能正向自发进行 | |
| B. | 用简易量热计测定反应热时,需用环形玻璃搅拌棒搅拌使酸和碱充分反应 | |
| C. | 化合反应一定是放热反应,分解反应不一定是吸热反应 | |
| D. | 为加快漂粉精的漂白速率,使用时可滴加几滴醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
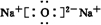 、
、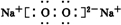 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下: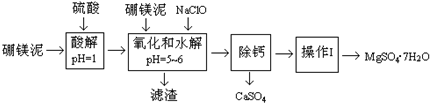
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{1}H$和$\frac{2}{1}H$互为同位素 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | 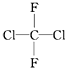 和 和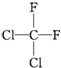 属于同一种物质 属于同一种物质 | D. | C2H6和C4H10互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
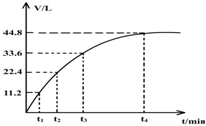 向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )| A. | t1 | B. | t2 | C. | t3 | D. | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
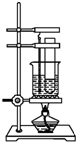 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com