
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
(1)卤族元素位于周期表的
区;溴的价电子排布式为
.
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)
2形式存在的.使氢氟酸分子缔合的作用力是
.
(3)请根据表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
.
|
氟 |
氯 |
溴 |
碘 |
铍 |
第一电离能
(kJ/mol) |
1681 |
1251 |
1140 |
1008 |
900 |
(4)已知高碘酸有两种形式,化学式分别为H
5IO
6(

)和HIO
4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H
5IO
6
HIO
4.(填“>”、“<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I
-+I
2=I
3-.与KI
3类似的,还有CsICl
2等.已知CsICl
2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
式发生.
A.CsICl
2=CsCl+ICl B.CsICl
2=CsI+Cl
2(6)已知ClO
2-为角型,中心氯原子周围有四对价层电子.ClO
2-中心氯原子的杂化轨道类型为
,写出一个ClO
2-的等电子体
.
(7)已知CaF
2晶体(见图)的密度为ρ g?cm
-3,N
A为阿伏加德罗常数,最近相邻的两个Ca
2+的核间距为a cm,则CaF
2的相对分子质量可以表示为
.

 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们. )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6 )中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;
)中含有5个羟基氢,为五元酸,含非羟基氧原子1个,HIO4为一元酸,含有1个羟基氢,含非羟基氧原子3个,所以酸性:H5IO6<HIO4,故答案为:<;


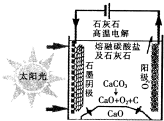 资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业
资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业

