
| A. | 10mL | B. | 15mL | C. | 25mL | D. | 30mL |
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液与FeCl3反应:HSO3-+2 Fe3++H2O═SO42-+2Fe2++3H+ | |
| B. | NaHSO3溶液和足量Ca(OH)2溶液反应:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| C. | NaHSO3溶液和稀HNO3反应:HSO3-+H+═SO2↑+H2O | |
| D. | NaHSO3溶液和NaAlO2溶液反应:HSO3-+AlO2-+H2O═SO32-+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

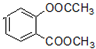 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+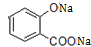 +H2O.
+H2O.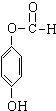 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和② | B. | ②和④ | C. | ④和⑥ | D. | ③和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 聚丙烯的结构简式为: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
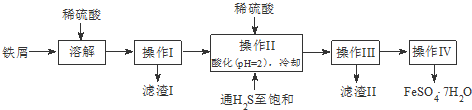
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
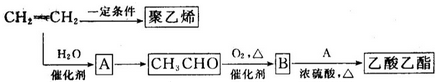
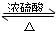 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com