
(13分)(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中,正极电极反应式为_________________,发生 反应(填氧化或还原);电子从 经外电路到 (填锌或铜),溶液中H+ 向 移动(填正极或负极)。
(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,所需负极材料为 ,溶液中Fe3+向 (填“负极”或“正极”)迁移,负极反应式为 ;正极反应式为 。
(1)2H++2e-=H2↑ 还原 锌 铜 正极
(2)Cu、正、 Cu-2e-=Cu2+ 2Fe3+ +2e- = 2Fe2+
解析试题分析:(1)将锌、铜用导线连接后浸入2mol/L的稀硫酸中形成原电池,该原电池中锌是负极,发生氧化反应,铜是正极,溶液中的氢离子得电子生成氢气,发生还原反应,电极反应式为2H++2e-=H2↑;外电路上,电子从负极沿导线到正极,即电子是从锌经外电路到铜;溶液中H+ 向正极移动。(2)根据反应2Fe3+ + Cu = 2Fe2++Cu2+ 设计原电池,铜的化合价由0价升高为+2价,发生氧化反应,作原电池的负极,电极反应式为Cu-2e-=Cu2+;电解质溶液中阳离子Fe3+向正极迁移,在正极上发生还原反应,电极反应式为2Fe3+ +2e- = 2Fe2+。
考点:考查原电池原理、电极方程式书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(10分) 如图所示装置: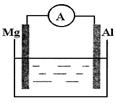
(1)若烧杯中溶液为稀硫酸,则观察到的现象为: 。
两极反应式为:正极 ;负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列四种装置中,均盛200mL的溶液。
①0.005 mol/LCuSO4溶液,②0.01 mol/LH2SO4,③ZnCl2溶液,④KCl溶液.
(1)上述四种装置中,为电解池的是 (用编号回答),装置①中两电极的电极反应式分别是:阴极: ,阳极: ;
(2)若将装置④中的外加电源拆去,用导线将两个电极连接,则Fe极上发生的反应是___________________,C极上发生的反应是 。
(3)工作一段时间后,测得导线上均通过0.002mol电子,则上述装置②中生成气体的体积是________ mL (标准状况);
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(l1分)物质A-E都是中学化学中常见的物质,它们可以发生如下图所示的反应,其中E是蓝色溶液。
(1)在以上反应中(用序号填空),属于氧化还原反应的是____________,属于离子反应的是____________。
(2)写出反应③的离子方程式:____________________________________________。
(3)反应⑦的速率如上图,其原因可能是________________________________。
(4)从上述框图中选取电极材料和电解质溶液组成原电池,其中正极材料是________________________。负极反应为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
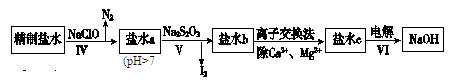
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如图 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,正极的电极反应式为____________;负极的电极反应式为____________。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池。若不能,请说明理由;若能,请说明在两电极上所发生的现象:________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液。则氢气应通入________(填“a”或“b”)极,正极上的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请按要求回答下列问题。

(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com