
 氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物.分析 (1)①F元素为-1价,根据化合物中化合价的代数和为零计算;
②将Fz通入稀的NaOH溶液中可得到OF2、NaF和水;
(2)①双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,第一步电离出一个氢离子;已知常温下1L的H2O2相当于48.3mol,K=$\frac{C({H}^{+})•C(H{{O}_{2}}^{-})}{C({H}_{2}{O}_{2})}$=1.67×10 -12,H2O2与Ba(OH)2作用形成正盐为BaO2,同时生成水;
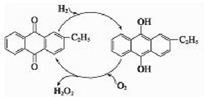
②乙基蒽醌作催化剂,氢气和氧气反应生成双氧水;
③水在阳极上失电子生成双氧水;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,则超氧化钾和二氧化碳反应生成碳酸钾和氧气.
解答 解:(1)①F元素为-1价,化合物中化合价的代数和为零,则OF2中O为+2价,故答案为:+2;
②将Fz通入稀的NaOH溶液中可得到OF2、NaF和水,其反应方程式为:2F2+2NaOH=2NaF+H2O+OF2,故答案为:2F2+2NaOH=2NaF+H2O+OF2;
(2)①双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,第一步电离出一个氢离子,则它的一级电离方程式为H2O2?H++HO2-;根据K=$\frac{C({H}^{+})•C(H{{O}_{2}}^{-})}{C({H}_{2}{O}_{2})}$=1.67×10 -12,则c(H+)=$\sqrt{1.67×1{0}^{-12}×48.3}$=9×10-6mol/L;H2O2与Ba(OH)2作用形成正盐为BaO2,同时生成水,其反应的方程式为:H2O2+Ba(OH)2=BaO2+2H2O;
故答案为:H2O2?H++HO2-;9×10-6mol/L;H2O2+Ba(OH)2=BaO2+2H2O;
②通过图示可知,用乙基蒽醌作催化剂制取双氧水,反应为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2,
故答案为:H2+O2$\frac{\underline{\;催化剂\;}}{\;}$H2O2;
③电解总方程式3H2O+3O2$\frac{\underline{\;电解\;}}{\;}$3H2O2+O3,水在阳极上失电子生成双氧水,其电极方程式:2H2O-2e-=H2O2+2H+,
故答案为:2H2O-2e-=H2O2+2H+;
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,则超氧化钾和二氧化碳反应生成碳酸钾和氧气,反应方程式为4KO2+2CO2=2K2CO3+3O2,
故答案为:4KO2+2CO2=2K2CO3+3O2.
点评 本题是一道综合知识题目,涉及化合价、弱电解质的电离、电离常数的应用、电解原理的应用、化学方程式的书写等,考查学生分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 铁有剩余 | |
| B. | 往溶液中滴入无色KSCN溶液,显红色 | |
| C. | Fe2+和Fe3+物质的量之比为6:1 | |
| D. | 氧化产物与还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | (C6H10O5)n 可表示淀粉或纤维素 | |
| B. | 反应②化学方程式为 C6H12O6$\stackrel{酒化酶}{→}$2C2H5OH+2CO2↑ | |
| C. | 反应③得到的乙酸乙酯中含有乙醇和乙酸,可用饱和氢氧化钠溶液除去 | |
| D. | 反应③和④都属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑨ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com