
| ||
| ||


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和的食盐水,阳极产物是氢氧化钠和氯气 |
| B、电解饱和的氯化钠溶液,在阴极析出钠 |
| C、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为2:1 |
| D、电解熔融的氯化钠,在阴极上和阳极上析出产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡发生移动,平衡常数必发生变化 |
| B、平衡常数发生变化,化学平衡必发生移动 |
| C、改变浓度,平衡常数一定改变 |
| D、催化剂改变达到平衡的时间,必引起平衡常数的改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
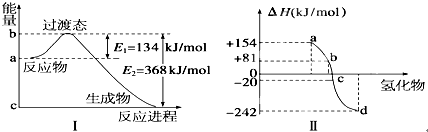
查看答案和解析>>
科目:高中化学 来源: 题型:
 出该加聚反应的化学方程式(可不写反应条件)
出该加聚反应的化学方程式(可不写反应条件)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向逆反应方向移动 |
| B、达新平衡时,c(N2)较原平衡变小 |
| C、达新平衡时,混合气体的密度变小 |
| D、达新平衡时正、逆反应速率均比原平衡变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com