
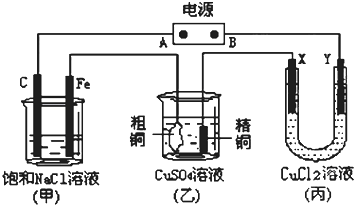
| ||
| ||


科目:高中化学 来源: 题型:
 ②
② ③
③ ④
④ ⑤CH3CH2OH⑥C6H12O6⑦CH3COOH
⑤CH3CH2OH⑥C6H12O6⑦CH3COOH| A、能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩ |
| B、投入钠能产生H2的是⑤⑦⑧⑨ |
| C、属于高分子材料的是⑧⑨⑩ |
| D、含碳量最高、有毒、常温下为液体且点燃时有浓烟的是① |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol
一定条件下,在2L的密闭容器中,发生下述反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:
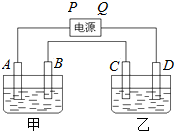 已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.
已知A、B、C、D都是铂电极,P、Q是直流电源的两极,通电后发现B极质量增加.查看答案和解析>>
科目:高中化学 来源: 题型:
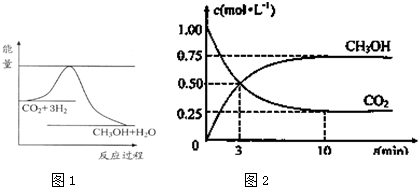
查看答案和解析>>
科目:高中化学 来源: 题型:
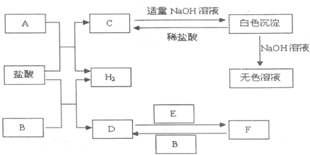 下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.
下列物质A~F是我们熟悉的单质或化合物,其中A、E均为C中元素形成的单质,B是常见的金属,且B的合金用量最大;在适当的条件下,它们之间可以发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质失电子的反应为还原反应 |
| B、物质在变化中得到电子,此物质是还原剂 |
| C、发生电子转移的反应即是氧化还原反应 |
| D、发生化合价升降的反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生石灰、铁粉常用于食品干燥剂 |
| B、“地沟油”经过加工处理后可用来制肥皂 |
| C、抗酸药如小苏打可治疗因胃酸过多引起的消化不良 |
| D、以粮食为原料酿酒过程的变化包括粮食一淀粉一葡萄糖一乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com