
| A、加热 |
| B、将稀硫酸改成98%的浓硫酸 |
| C、滴加少量CuSO4溶液 |
| D、不用铁片,改用铁粉 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
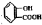 )、丙烯、乙烯为原料合成一种长效缓释阿司匹林片的路线如下:
)、丙烯、乙烯为原料合成一种长效缓释阿司匹林片的路线如下:
| Cl |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )
如图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素.下列关于这四种元素及其化合物的说法中正确的是( )| A、Y元素的非金属性是表中所列元素中最强的 |
| B、X的最高正价可能为+6价 |
| C、W的最高正化合价与最低负化合价的绝对值不可能相等 |
| D、Z的最高价氧化物的水化物可能为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com