
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
分析 该反应为气体体积减小的反应,则减小压强,平衡逆向移动,K只与温度有关,以此来解答.
解答 解:A.K只与温度有关,恒温发生反应,则平衡常数K不变,故A正确;
B.减小压强,平衡逆向移动,n(O2)增大,故B正确;
C.减小压强,平衡逆向移动,SO2的物质的量、气体的总物质的量均增大,体积分数可能减小,故C错误;
D.减小压强,平衡逆向移动,SO2的物质的量增大,密闭容器的体积的体积不变,c(SO2)增大,故D正确;
故选C.
点评 本题考查化学平衡的移动,为高频考点,把握压强对平衡移动的影响、K只与温度有关为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
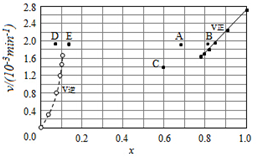 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
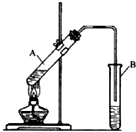 实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.
实验室制取乙酸乙酯的反应装置如图所示,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
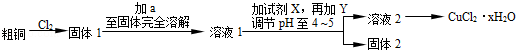
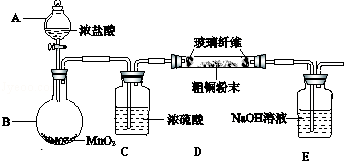
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁的金属活动性比铷强,故镁可置换铷 | |
| B. | 铷的沸点比镁低,把铷蒸气抽出时,平衡右移 | |
| C. | MgCl2的热稳定性比RbCl弱 | |
| D. | Rb单质比RbCl更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的速率主要取决于①的快慢 | |
| B. | NOBr2是该反应的催化剂 | |
| C. | 正反应的活化能比逆反应的活化能小a kJ•mol-1 | |
| D. | 增大Br2(g)浓度能增大活化分子百分数,加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
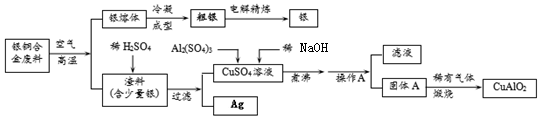
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com