
在一定温度下可逆反应N2+3H2 2NH3已达到平衡,下列有关说法正确的 ( )
2NH3已达到平衡,下列有关说法正确的 ( )
①1个N≡N键断裂的同时,有3个H—H键形成
②反应混合物中各组分的体积分数保持不变
③恒温恒容时,容器内的压强不再改变
④1个N≡N键断裂的同时,有3个N—H 键形成
⑤NH3生成的速率与NH3分解的速率相等
⑥单位时间生成n molN2,同时生成2n molNH3
⑦气体的平均相对分子质量不再改变
⑧N2 H2 NH3的分子数一定为1∶3∶2
⑨恒温恒容时,气体的总物质的量不再改变
⑩恒温恒压时,容器内的密度不再改变
| A.①②③④⑤⑥⑦⑨ | B.①②③⑤⑥⑩ |
| C.③④⑤⑥⑦⑧ | D.①②③⑤⑥⑦⑨⑩ |
D
解析试题分析:① 1个N≡N键断裂的同时,有3个H—H键断裂,若形成3个H—H键。单位时间内H—H键断裂的个数与形成的个数相等。证明达到平衡。②反应达到平衡时各物质的物质的量不变,反应混合物中各组分的物质的量也不变,所以体积分数保持不变。正确。③恒温恒容时,反应达到平衡时个种气体的物质的量不变,总物质的量也不变,所以容器内的压强不再改变。正确。④ 在任何时刻每有1个N≡N键断裂的同时,就有3个N—H 键形成,这是反应向正反应方向进行,不能说明反应达到平衡。错误。⑤ NH3生成的速率与NH3分解的速率相等,则氨气的浓度不变,反应达到平衡。正确。⑥单位时间生成n molN2,必然消耗2nmol NH3。同时生成2n molNH3。则NH3的浓度不变,达到平衡。正确。⑦反应符合质量守恒定律。如果气体气体的平均相对分子质量不再改变,说明气体的物质的量不变,即反应达到平衡。正确。⑧N2 H2 NH3的分子数一定为1∶3∶2 只是反应过程中的一个非常特殊的情况,可能达到平衡,一可能没达到平衡。错误。⑨该反应是个反应前后气体体积不等的反应,若恒温恒容时,气体的总物质的量不再改变,即各物质消耗的浓度与生成的浓度相等,反应达到平衡。正确。⑩恒温恒压时,容器内的密度不再改变 也就是气体的物质的量不变。该反应是反应前后气体体积不等的反应,若气体的物质的量不变,则反应达到平衡。正确。正确的说法是①②③⑤⑥⑦⑨⑩。选项为:D。
考点:考查可逆反应平衡状态的判断的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
已知某反应aA(g) +bB(g)  cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是
cC(g) ΔH ="Q" 在密闭容器中进行,在不同温度(T1 和T2 )及压强(P1 和P2 )下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是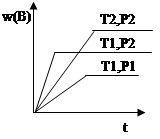
A.T1<T2, P1<P2 ,a+b>c ,Q>0
B.T1>T2 ,P1<P2 ,a+b<c ,Q<0
C.T1<T2 ,P1>P2 ,a+b<c, Q>0
D. T1<T2 ,P1>P2 ,a+b>c ,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定条件下,对于反应mA(g)+nB(g) cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )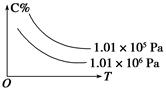
| A.ΔH<0 ΔS>0 | B.ΔH>0 ΔS<0 |
| C.ΔH>0 ΔS>0 | D.ΔH<0 ΔS<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g)+ CH3OCOOCH3(g)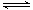 2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )
2 CH3OCOOC2H5(g).其他条件相同,CH3OCOOCH3的平衡转化率(α)与温度(T),反应物配比(R=n(C2H5OCOOC2H5):n(CH3OCOOCH3))的关系如下图所示.三种反应物配比分别为1:1,2:1,3:1.下列说法不正确的是( )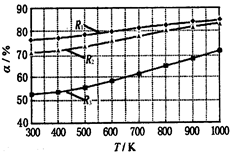
| A.该反应△H > 0 |
| B.R1对应的反应物配比为3:1 |
| C.650℃,反应物配比为1:1时,平衡常数K = 6 |
| D.该反应为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
、反应A(g)+3B(g) 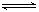 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是
A.υ(D)="0.4" mol / (L·s) B.υ(C)="0.5" mol / (L·s)
C.υ(B)="0.6" mol / (L·s) D.υ(A)="0.15" mol / (L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应在一定压强下,达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定压容器,n(NH3) >1.2mol |
| C.若为定容容器,n(NH3)>1.2mol | D.若为定压容器,n(NH3)<1.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在密闭容器中,一定量混合气体发生下列反应: aM(g)+ bN(g)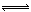 cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
cW(g),达到平衡后,测得M气体的浓度为0.5mol/L。恒温下,将密闭容器的体积扩大1倍,再达平衡时,测得M气体的浓度为0.3mol/L。则下列叙述正确的是( )
| A.反应速率增大 | B.平衡向正反应方向移动 |
| C.N的转化率提高 | D.W的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
| A.①③④ | B.②⑥⑦ | C.③④⑤ | D.②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图表示反应A(g)+B(g) nC(g) △H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是
nC(g) △H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述正确的是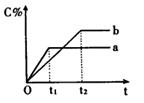
| A.反应由逆反应开始 |
| B.a表示有催化剂,b表示无催化剂 |
| C.若n=2,其它条件相同,a比b的压强大 |
| D.若其它条件相同,a比b的温度高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com