
分析 (1)根据盖斯定律,由已知热化学反应方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数进行相应的加减,据此书写;
(2)部分电离的电解质是弱电解质,该溶液中氢离子浓度小于酸浓度,则HA是弱酸,部分电离;
(3)①盐酸是强酸、醋酸是弱酸,相同浓度的盐酸和醋酸,HCl电离程度大于醋酸,一元酸电离程度越大该酸溶液中氢离子浓度越大;
②pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释过程中醋酸继续电离.
解答 解:(1)已知:①、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-l;
②、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ•mol-l;
由盖斯定律,②×2-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g),故该反应的△H=2×(-534kJ•mol-1)-67.7kJ•mol-1)=-1135.7 kJ•mol-1,
即2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7 kJ•mol-1;
(2)酸中氢离子浓度小于HA,则HA部分电离,为弱电解质,是弱酸,其电离方程式为HA?H++A-,
故答案为:弱;HA?H++A-;
(3)①盐酸是强酸、醋酸是弱酸,相同浓度的盐酸和醋酸,HCl电离程度大于醋酸,一元酸电离程度越大该酸溶液中氢离子浓度越大,所以c(H+):a>b,故答案为:>;
②pH相同的醋酸和盐酸,醋酸浓度大于盐酸,稀释过程中醋酸继续电离,所以稀释相同的倍数时,醋酸中氢离子浓度大于盐酸,则pHa>b,故答案为:>.
点评 本题考查弱电解质的电离和盖斯定律,侧重考查学生分析计算能力,明确弱电解质电离特点是解本题关键,注意:电解质强弱与其电离程度有关,与电解质溶液导电性强弱无关,易错点是pH相同的不同一元酸浓度关系.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ③④ | C. | ③④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
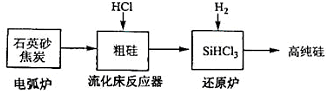
| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\stackrel{1600-1800℃}{?}$Si+2CO↑ |
| 流化床反器 | Si+3HCl$\stackrel{250-300℃}{?}$SiHCl3+H2 |
| 还原炉 | SiHCl3+H2$\stackrel{1100-1200℃}{?}$Si+3HCl |
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
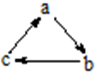 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| a | b | c | |
| A | Al | AlCl3 | Al(OH)3 |
| B | HCl | H2CO3 | HClO |
| C | Si | SiO2 | H2SiO3 |
| D | NaOH | NaHCO3 | Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4 | B. | c(H+)=0.001 mol•L-1 | ||
| C. | c(OH- )=1×10-11 mol•L-1 | D. | c(H+):c(OH- )=1×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯(乙炔):酸性高锰酸钾溶液 | |
| B. | 溴苯(苯):液溴、铁粉 | |
| C. | 乙烷(乙烯):氢气、镍 | |
| D. | 苯(甲苯):酸性高锰酸钾溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com