
| 选项 | 现象或事实 | 解释 |
| A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
| B. | 液氨常用作制冷剂 | 液氨汽化时要吸收大量的热 |
| C. | 利用静电除尘装置除去粉尘 | 胶体粒子带电 |
| D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化吸收大量的热 |
| A. | A | B. | B | C. | C | D. | D |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
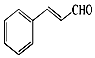 自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )
自然界中的许多植物中含有醛,其中有些具有特殊的香味,可作为植物香料使用.桂皮中含有肉桂醛,结构如图,杏仁中含有苯甲醛.以下说法错误的是( )| A. | 肉桂醛分子中含有两种官能团,分子式为C9H8O | |
| B. | 肉桂醛分子中最多有18个原子共平面 | |
| C. | 1 mol肉桂醛与氢气加成时最多消耗4 mol H2 | |
| D. | 肉桂醛与苯甲醛不是同系物,但都能发生氧化反应和还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液 | |
| C. | 用水润湿pH试纸测量某溶液的PH | |
| D. | 实验室用NaOH溶液除去Cl2中的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3分子呈三角锥形 | |
| B. | PH3分子是极性分子 | |
| C. | PH3中P 采取sp2杂化 | |
| D. | PH3分子稳定性低于NH3分子,因为N-H键键能高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的铝分别与足量Fe2O3或Fe3O4发生铝热反应时,转移电子的数目相等 | |
| B. | 质量分数分别为40%和60%的硫酸溶液等体积混合,所得溶液的质量分数为50% | |
| C. | 金属钠着火时,立即用泡沫灭火器灭火 | |
| D. | 洗涤做焰色反应的铂丝,可选用稀盐酸或稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
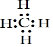 ; B与D组成的三原子分子的结构式为O=C=O.
; B与D组成的三原子分子的结构式为O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1NH4Cl溶液中,NH4+的数量为0.1NA | |
| B. | 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA | |
| C. | 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA | |
| D. | 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )| A. | 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 | |
| B. | 电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g | |
| C. | 石墨烯的作用主要是提高电极a的导电性 | |
| D. | 电池充电时间越长,电池中的Li2S2量越多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com