

分析 由题给数据可知Fe3+易生成Fe(OH)3沉淀而除去,加入氧化剂X的目的是把亚铁离子氧化,为避免引入新杂质,应用过氧化氢;加入试剂Y的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体,以此解答该题.
解答 解:(1)Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,
故答案为:将Fe2+氧化为Fe3+,再除去;
(2)调节pH至3.7,使Fe3+全部沉淀,加入Y不能引入新杂质,所以Y最好为CuO或Cu(OH)2,
故答案为:CuO或Cu(OH)2;
(3)CuO能促进三价铁离子的水解,涉及的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O,
故答案为:Fe3++3H2O?Fe(OH)3+3H+,CuO+2H+═Cu2++H2O.
点评 本题考查物质的分离、提纯的实验设计,为高频考点,侧重于学生的分析能力的考查,注意对工艺流程理解与实验条件控制、实验方案的评价、物质分离提纯除杂等有关实验操作,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 二茂铁属于分子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 已知环戊二烯的结构式为: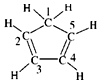 ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | C5H5-中一定含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤⑦ | C. | ②③⑥ | D. | ③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$→_{醇溶液}^{NaOH}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
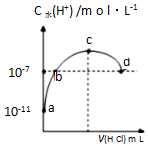 常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )
常温下,向20mL 0.1mol•L-1氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示.则下列说法正确的是( )| A. | 常温下,0.1mol•L-1氨水的电离常数K约为1×10-5mol•L-1 | |
| B. | a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| C. | c点溶液中c(NH4+)=c(Cl-) | |
| D. | d点代表两溶液恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下混合气体的体积为22.4L | |
| B. | 完全燃烧生成44g CO2 | |
| C. | 混合气体中氢原子个数为2NA | |
| D. | 完全燃烧转移的电子数为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焰火的五彩缤纷是某些金属元素化学性质的表现 | |
| B. | 工业上以氯气和石灰乳为原料制备漂白粉 | |
| C. | 用活性炭为蔗糖脱色和用臭氧漂白纸浆的原理相似 | |
| D. | 明矾作为净水剂,可以除去废水中的铜离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com