
下列说法正确的是( )
|
| A. | 焓变等于反应物的总能量减去生成物的总能量 |
|
| B. | 焓变等于反应物的键能总和减去生成物的键能总和 |
|
| C. | 断裂化学键是放热过程 |
|
| D. | 形成新的化学键是吸热过程 |
考点:
反应热和焓变.
专题:
化学反应中的能量变化.
分析:
化学反应的实质是旧键的断裂和新键的生成,旧键断裂吸收能量,形成新键放出能量,焓变等于生成物的总能量减去反应物的总能量或反应物的键能总和减去生成物的键能总和.
解答:
解:A.焓变等于生成物的总能量减去反应物的总能量,故A错误;
B.焓变等于反应物的键能总和减去生成物的键能总和,如吸收能量少,放出能量多,则为放热反应,故B正确;
C.断裂化学键是吸热过程,故C错误;
D.形成新的化学键是放热过程,故D错误.
故选B.
点评:
本题考查化学反应与能量变化,侧重于焓变与反应热的理解,题目较为基础,注意相关知识的学习.


科目:高中化学 来源: 题型:
某同学写出的下列烷烃的名称中,不正确的是( )
|
| A. | 2,3﹣二甲基丁烷 | B. | 2,2﹣二甲基丁烷 |
|
| C. | 3﹣甲基﹣2﹣乙基戊烷 | D. | 2,2,3,3﹣四甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组拟制备K3[Fe(C2O4)3]·3H2O晶体
Ⅰ.查 阅资料
阅资料
K3[Fe(C2O4)3]·3H2O是翠绿色晶体,易溶于水,难溶于乙醇,具有光敏性,光照分解。
110℃失去结晶水,230℃时分解。K3[Fe(C2O4)3]·3H2O的摩尔质量是491g/moL
Ⅱ.制备产品
实验步骤如下:
① 取27.8gFeSO4·7H2O和K2C2O4反应生成草酸亚铁
② 将草酸亚铁(FeC2O4)和适量K2C2O4的混合溶液置于40℃的恒温水浴中,逐滴加入 6% H2O2,边加边搅拌,使Fe2+充分被氧化。反应体系中生成K3[Fe(C2O4)3]的同时还有部分
Fe(OH)3沉淀
③ 向②所得浊液中加入1mol/LH2C2O4溶液,使溶液变为翠绿色
④ 加热浓缩,冷却结晶,过滤,洗涤,干燥,称量产品的质量为ag
请回答下列问题:
(1)第②步需要控制水浴40℃,温度不能太高的主要目的: ,若第④ 步冷却时间较长,需将溶液置于冷暗处,原因是: 。
步冷却时间较长,需将溶液置于冷暗处,原因是: 。
(2)第②步中,为检验Fe2+是否已完全被氧化,可选用 。试剂(填字母)
A. NaOH溶液 B. K3Fe(CN)6溶液 C. 苯酚溶液 D. KSCN溶液
(3)请写出第③步中加入H2C2O4溶液将Fe(OH)3沉淀反应生成K3[Fe(C2O4)3]的化学反应方程式: 。
(4)步骤④中的实验操作需要下列仪器中的 (填仪器的编号).
①酒精灯 ②燃烧匙 ③烧杯 ④广口瓶 ⑤研钵 ⑥玻璃棒
(5)有同学为提高产率,避免第④步加热浓缩过程中K3[Fe(C2O4)3]的少量分解,依 据查阅的资料提出新的结晶方案:将步骤③得到的溶液中加入 ,过滤,洗涤,干燥,称量。
据查阅的资料提出新的结晶方案:将步骤③得到的溶液中加入 ,过滤,洗涤,干燥,称量。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
|
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐增强 |
|
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
|
| D. | 原子最外层电子数大于4的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸.当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素.回答下列问题: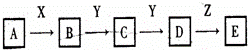
(1)A是 ,Y是 ,Z是 .
(2)当X是强碱时,E是 ,当X是强酸,E是 .
(3)写出A与X反应的离子方程式:
① ;
② .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,可逆反应3X(g)+Y(g)⇌2Z(g)达到限度的标志是( )
|
| A. | 单位时间内生成3nmolX,同时消耗nmolY |
|
| B. | X、Y、Z的浓度相等 |
|
| C. | X的生成速率与Z的生成速率相等 |
|
| D. | X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在做制乙烯实验中,发现有“刺激性气体产物,且烧瓶中的溶液变黑色”,他们认为可能的气体产物有乙烯、二氧化碳、二氧化硫等.已知:CH3CH═CH2与酸性高锰酸钾溶液反应生成CH3COOH、CO2.

(1)实验室制乙烯实验中,下列错误操作可能引发安全事故的是 .
A.加热温度没有迅速升至170℃
B.忘记加碎瓷片
C.直接加热烧瓶
D.用医用消毒酒精
E.实验完毕,先熄灭酒精灯,后拆导管
(2)中学化学中温度计的作用有:①测定溶液温度,②测定 温度.
(3)甲同学设计如图1及图2所示装置检验该气体产物:方案Ⅰ,不能检验 二 ;方案Ⅱ,能检验 .
(4)乙同学认为制乙烯过程中,可能有CO产生,他在甲同学设计的装置后面连接如图3所示装置,探究是否有一氧化碳生成.
①乙同学应在甲同学设计的 (填“方案Ⅰ”、“方案Ⅱ”或“方案Ⅰ和方案Ⅱ”)的装置后面连接该装置;
②A瓶装的试剂是 ;
③B的硬质试管中装入 ,确认有一氧化碳生成的实验现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
高温下,某反应达到平衡,平衡常数K=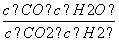 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O
 CO2+H2
CO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com