
| A. | Al3+ | B. | Fe2+ | C. | Al | D. | Br- |
 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氨水与稀盐酸反应:H++OH-═H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+6H+═3I2+3H2O | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
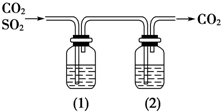 CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )
CO2气体中含有少量SO2,欲得到干燥纯净的CO2,通过下图所示的洗气瓶,(1)、(2)两瓶中所装的试剂应该是( )| A. | (1)NaOH (2)浓H2SO4 | B. | (1)浓H2SO4 (2)NaOH | ||
| C. | (1)饱和NaHCO3 (2)浓H2SO4 | D. | (1)浓H2SO4 (2)Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 基态碳原子核外电子排布图是: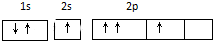 | |
| B. | 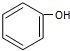 和 和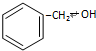 是同系物,性质相似 是同系物,性质相似 | |
| C. | 过氧化钠的电子式: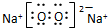 | |
| D. | 常见的化学键有:离子键、共价键、金属键、氢键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| B. | 向Fe(NO3)3溶液中通入足量HI气体:2Fe3++2I-═2Fe2++I2 | |
| C. | 向NaHCO3溶液中滴入少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向水玻璃溶液中通入过量CO2:SiO32-+H2O+CO2═CO32-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
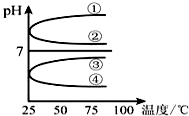 (1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).
(1)稀释0.1mol•L-1氨水时,随着水量的增加而减小的是①②(填写序号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com